今有Na2CO3、NaHCO3、NaCl组成的混合物100g,加热到质量不再减少为止。剩余残渣为84.5g,将残渣溶于水,滴入足量的AgNO3溶液得到白色沉淀,加足量的稀硝酸后大部分沉淀消失,剩余沉淀为12.26g,试计算混合物中Na2CO3、NaHCO3、和NaCl的质量分数各是多少?
在恒温时,向某密闭容器中通入2mol X和1mol Y气体,发生如下反应:
2X(气)+Y(气) 2Z(气),压强一定时,测得在平衡时Z的体积分数为0.4。
2Z(气),压强一定时,测得在平衡时Z的体积分数为0.4。
(1)与上述平衡保持同温、同压,若向密闭容器中通入4mol X(气)、2mol Y(气),达到平衡,则Z的体积分数为;平衡时,气体的总物质的量是。
(2)若向密闭器中通入X(气)和Y(气)的物质的量分别记为n(X)、n(Y),保持容器容积不变,并满足平衡时Z的体积分数为0.4,则n(X)/n(Y)的取值范围为。
一定条件下,可逆反应:A2+B2 2C达到平衡。经测定,平衡时c(A2)=0.5mol/L,c(B2)=0.1mol/L,c(C)=1.6mol/L,若A2、B2和C的起始浓度分别为amol/L,bmol/L,cmol/L。
2C达到平衡。经测定,平衡时c(A2)=0.5mol/L,c(B2)=0.1mol/L,c(C)=1.6mol/L,若A2、B2和C的起始浓度分别为amol/L,bmol/L,cmol/L。
请回答:
(1)a、b应满足的关系是 (2)a的取值范围是
在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图。反应在t时到达平衡,依图所示: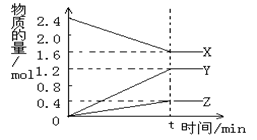
①该反应的化学方程式是 。
②反应起始至t,Y的平均反应速率是。
写出下列物质的电子式,有结构式的请写出结构式
①氨气、②氯化铵、
③干冰、④苛性钠、
⑤冰、⑥过氧化钠、
⑦双氧水、⑧HClO、
由锌和铜构成的合金共10 g,放入足量的稀盐酸中充分反应,产生标准状况下气体2.24L,试求合金中铜的质量分数。