在一定温度和压强下,2体积X2气体与3体积Y2气体恰好完全反应,生成2体积气体化合物Z,则Z的化学式可能是( )
| A.X2Y3 | B.XY | C.X3Y | D.XY3 |
某温度下,将2 mol A和3 mol B充入一密闭容器中,发生反应:aA(g)+B(g) C(g)+D(g),5 min后达到平衡.已知该温度下其平衡常数K=1,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化,则下列说法正确的是
C(g)+D(g),5 min后达到平衡.已知该温度下其平衡常数K=1,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化,则下列说法正确的是
| A.a=3 | B.a=2 |
| C.B的转化率为40% | D.B的转化率为60% |
下列叙述中不正确的是
| A.电解池的阳极上发生氧化反应,阴极上发生还原反应 |
| B.不能自发进行的氧化还原反应可通过电解的原理实现 |
| C.电镀时,电镀池里的阳极材料发生氧化反应 |
| D.电解饱和食盐水时,阳极得到氢氧化钠溶液和氢气 |
100 mL浓度为2 mol·L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是
| A.加入数滴氯化铜溶液 | B.加入适量的6 mol·L-1的盐酸 |
| C.加入适量蒸馏水 | D.加入适量的氯化钠溶液 |
在一密闭容器中,反应mA(g)+nB(g) pC(g)达到平衡时,测得c(A)为0.5 mol·L-1;在温度不变的条件下,将容器体积扩大一倍,当达到平衡时,测得c(A)为0.3 mol·L-1。则下列判断正确的是
pC(g)达到平衡时,测得c(A)为0.5 mol·L-1;在温度不变的条件下,将容器体积扩大一倍,当达到平衡时,测得c(A)为0.3 mol·L-1。则下列判断正确的是
A.化学计量数:m+n<p B.平衡向正反应方向移动
C.物质B的转化率减小 D.物质C的质量分数增加
在容积可变的密闭容器中存在如下反应:2A(g)+2B(g) C(g)+3D(g) ΔH<0。
C(g)+3D(g) ΔH<0。
该可逆反应的反应速率-时间、转化率-时间关系图如下: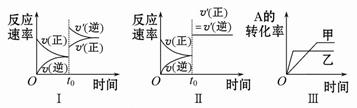
下列分析中不正确的是
| A.图Ⅰ可体现t0时升高温度对反应速率的影响 |
| B.图Ⅱ可体现t0时增大压强(缩小体积)或使用催化剂对反应速率的影响 |
| C.图Ⅲ可体现催化剂对化学平衡的影响,且甲使用了催化剂 |
| D.图Ⅲ可体现温度对化学平衡的影响,且乙的温度较高 |