A、B、C、D、E为中学常见的五种物质,均含元素Y,有的还可能含有元素X、Z,元素X、Y、Z的原子序数依次递增。
①元素Y在A、B、C、D、E中所呈现的化合价依次递增,其中只有B为单质;
②常温下将气体D通入水中发生反应,生成C和E;
③工业上以A、空气和水为原料,通过催化氧化法制取E。
请回答以下问题:
(1)B的电子式为:______,A的结构式为__________,A分子的空间构型是_______;
(2)写出②中涉及反应的化学方程式_____________________________________。
(3)由B反应生成1 molA放出的热量为46.2kJ,写出该反应的热化学方程式,并注明反应条件____________________________________________________________________。
(4)工业上,若输送Cl2的管道漏气,用A进行检验时可观察到大量白烟,同时有B生成,写出有关反应的化学方程式_______________________________________,生成的大量白烟属于_______化合物。
(1)已知: C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
C(s)+H2O(g)=CO(g)+H2(g)ΔH2=+131.3 kJ/mol
则反应CO(g)+H2(g) +O2(g)= H2O(g)+CO2(g),ΔH= _______kJ/mol。
(2)在一恒容的密闭容器中,由CO和H2合成甲醇:CO(g)+2H2(g) CH3OH(g)ΔH
CH3OH(g)ΔH
①下列情形不能说明该反应已达到平衡状态的是_______(填序号)。
A.每消耗1 mol CO的同时生成2molH2
B.混合气体总物质的量不变
C.生成CH3OH的速率与消耗CO的速率相等
D.CH3OH、CO、H2的浓度都不再发生变化
②CO的平衡转化率(α)与温度、压强的关系如图所示。A、B两点的平衡常数K(A)_______K(B)(填“>”、“=”或“<”,下同);由图判断ΔH _____0。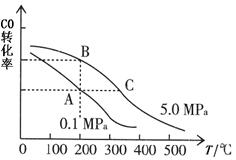
③某温度下,将2.0 mol CO和6.0 molH2充入2 L的密闭容器中,充分反应后,达到平衡时测得c(CO)="0.25" mol/L,则CO的转化率=,此温度下的平衡常数K=(保留二位有效数字)。
(3)工作温度650℃的熔融盐燃料电池,用煤炭气(CO、H2)作负极反应物,空气与CO2的混合气体为正极反应物,催化剂镍作电极,用一定比例的Li2CO3和Na2CO3低熔点混合物作电解质。负极的电极反应式为:CO+H2-4e-+2CO32-=3CO2+H2O;则该电池的正极反应式为。
工业上用甲苯生产对羟基苯甲酸乙酯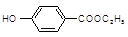 ,生产过程如下图:
,生产过程如下图: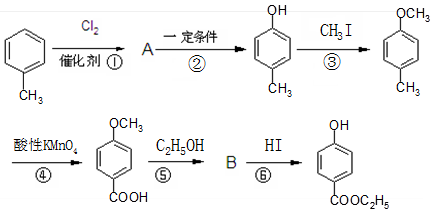
(1)对羟基苯甲酸乙酯的分子式为;1mol 该物质与NaOH溶液完全反应,最多消耗______molNaOH。
(2)化合物A中的官能团名称是_________,反应④的反应类型属________。
(3)反应①的化学方程式_______________。
(4)在合成线路中,设计第③和⑥这两步反应的目的是__________。
(5)有机物C(分子构型为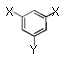 ,-X、-Y为取代基)是对羟基苯甲酸乙酯的同分异构体且能发生银镜反应,则-X的结构简式可能是、。
,-X、-Y为取代基)是对羟基苯甲酸乙酯的同分异构体且能发生银镜反应,则-X的结构简式可能是、。
某同学利用如图装置制NO并进行相关实验探究。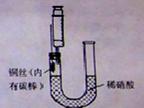
(1)写出制备NO的反应方程式
(2)收集的气体与空气混合后变红色,这说明NO具有_____性。
(3)制备NO的步骤如下:
1按图所示连接好装置;
2取下注射器,通过U型长管加入稀硝酸至接近U型短管的铜丝
3在针头上安装好注射器,抽出U型短管中的所有空气;然后拔出注射器,并排尽注射器中的空气。
4待硝酸与铜丝分离后,用已排除空气的注射器抽出生成NO,将注射器针头插入橡皮塞中以封口。
在上述操作中遗漏的一个步骤是,在步骤3中可以观察到的现象为。
(4)在铜丝上绑上石墨的作用是。
(5)若将稀硝酸换成浓硝酸,则可制取NO2气体。请你用注射器收集NO2气体并完成“外界因素对化学平衡移动影响”实验探究,相关内容填在下面表格。(只完成一个影响因素的探究,其他实验用品自选)已知
2NO2(g)  N2O4(g) △H <0;N2O4为无色气体。
N2O4(g) △H <0;N2O4为无色气体。
| 实验步骤 |
实验现象 |
实验结论 |
| ①分别用两支注射器收集NO2,并将注射器针头插入橡皮塞中以封口。 ②_____________________ _______________________ ________________________ _______________________ ________________________ |
_______________________ ________________________ _______________________ ________________________ _______________________ _______________________ ________________________ _______________________ |
_______________________ ________________________ _______________________ ________________________ _______________________ _______________________ ________________________ _______________________ |
工业上利用含有一定浓度的I2和CuSO4溶液的工业废水制备饲料添加剂Ca(IO3)2,其生产流程如下:
已知:Ca(IO3)2微溶于水,溶于硝酸;Ksp(CuI)=1.1×10-12, Ksp(Cu2S)=2.5×10-48;
氧化性: HNO3>IO3—>H2O2
(1)“还原”过程中主要反应的化学方程式为:2Na2S2O3+I2 =+ 2NaI。
(2)在还原过程还伴随有CuI生成,写出加入Na2S的离子反应方程式。
(3)在氧化过程中先加入H2O2再加入浓硝酸,而不直接加入浓硝酸的目的是。
(4)加入的石灰乳在溶液中反应而得到Ca(IO3)2,则要调节pH至(填“酸性” 或“中性”或“碱性”),原因是。
(5)Ca(IO3)2也可用电化学氧化法制取:先充分电解KI溶液,然后在电解后的溶液中加入CaCl2,最后过滤得到Ca(IO3)2。写出电解时阳极发生的电极反应方程式 ,用该方法制取Ca(IO3)2,每1kg碘化钾理论上可生产纯度为97.8%Ca(IO3)2的质量为____kg(计算结果保留3位有效数字)。
甲醇是一种重要的化工原料。甲醇与水蒸气催化重整可获得清洁能源,具有广泛的应用前景。现有如下实验,在体积为1 L的密闭容器中,充入1mol CH3OH和1molH2O,一定条件下发生反应:CH3OH (g)+ H2O (g) CO2(g) +3 H2 (g),测得CO2和CH3OH(g)的浓度随时间变化如下表所示。
CO2(g) +3 H2 (g),测得CO2和CH3OH(g)的浓度随时间变化如下表所示。
| 时间 物质 |
0 min |
10 min |
30 min |
60 min |
70 min |
| CO2(mol/L) |
0 |
0.2 |
0.6 |
0.8 |
0.8 |
| CH3OH(mol/L) |
1.0 |
0.8 |
0.4 |
0.2 |
0.2 |
①已知:CH3OH (g)+  O2 (g)
O2 (g) CO2(g) + 2H2 (g)H1= —192.9kJ/mol
CO2(g) + 2H2 (g)H1= —192.9kJ/mol
H2(g)+ O2 (g)
O2 (g) H2 O(g)H2= —120.9kJ/mol
H2 O(g)H2= —120.9kJ/mol
则甲醇与水蒸气催化重整反应的焓变△H3=_____。
②10~30 min内,氢气的平均反应速率v(H2)=___________mol/(L·min)。
③该反应的平衡常数表达式为K=__________________。
④下列措施中能使平衡时n(CH3OH)/n(CO2)减小的是(双选)___________。
A.加入催化剂 B.恒容充入He(g),使体系压强增大
C.将H2(g)从体系中分离D.再充入1molH2O
(2)甲醇在催化剂条件下可以直接氧化成甲酸。
①在常温下,用0.1000 mol/L NaOH溶液滴定20. 00 mL 0.1000 mol/L 甲酸溶液过程中,当混合液的pH=7时,所消耗的V(NaOH)___(填“<”或“>”或“=”) 20. 00 mL。
②在上述滴定操作中,若将甲酸换成盐酸,请在图中的相应位置画出相应的滴定曲线。(1滴溶液约0.04mL)