下列表示物质结构的化学用语或模型正确的是
| A.8个中子的碳原子的核素符号:12C | B.HF的电子式: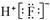 |
C.Cl-离子的结构示意图: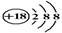 |
D.CH4分子的比例模型: |
下列物质中能用来干燥NH3的是
| A.浓硫酸 | B.碱石灰 | C.AlCl3溶液 | D.食盐水 |
煤是我国的一种主要能源,在使用煤资源时,下列所采取的措施不合理的是
| A.燃煤时应将煤块粉碎或磨成粉末 | B.燃煤时应通入足量的空气,且越多越好 |
| C.将煤制成水煤气 | D.将煤经过处理制成甲醇等 |
某同学为了使反应2HCl+2Ag===2AgCl+H2↑能进行,设计了如图所示的四个实验,你认为可行的方案是( )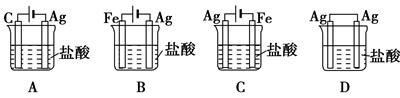
用石墨做电极电解下列溶液,通电一段时间后溶液的pH变大的是
| A.NaCl溶液 | B.NaOH溶液 | C.H2SO4溶液 | D.CuSO4溶液 |