写出下列叙述中有关物质的结构简式;分子式为C3H7Br的卤代烃经消去反应后得到的有机物是_________________________;能与金属钠反应,但不能与氢氧化钠反应的芳香族化合物C7H8O是___________________;含C、H、O三种元素的有机物,燃
烧时消耗的氧气和生成的CO2、H2O之间物质的量之比为1:2:2,则此类有机物中最简单的一种是________________
在63Li、73Li、2311Na、2412Mg、146C、147N中, 63Li和73Li 互称146C和 147N的相等(填质子数,中子数,质量数,电子数,下同),2311Na和2412Mg的相等.
按要求写出下列方程式:
氯气通入氢氧化钠溶液
氯化铵和氢氧化钠共热
Al2(SO4 ) 3的电离方程式
⑴1mol H2SO4中含______mol个氧原子,个氢原子。
⑵3.6g水与________g硫酸所含的分子数相等,它们所含氧原子数之比是。
现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示: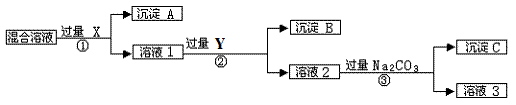
请回答下列问题:
(1)写出实验流程中下列物质的化学式。试剂X :,沉淀A:,试剂Y:,沉淀B:。
(2)上述实验流程中加入过量的Na2CO3的目的是。
(3)按此实验方案得到的溶液3中肯定含有(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的,之后若要获得固体NaNO3需进行的实验操作是(填操作名称)。
(4)写出实验流程①②所涉及的离子方程式。
①;② 。
。
(5分)铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾、次氯酸等还强。工业上制取铁酸钠的化学方程式是(未配平):
Fe(NO3)3 + NaOH + Cl2 → Na2FeO4 + NaNO3 + NaCl + H2O
(1)铁酸钠中,铁元素的化合价是;上述制取铁酸钠的反应中,铁元素被(填“还原”或“氧化”)。
(2)铁酸钠溶解于水,立即与水发生剧烈反应,放出氧气,正是这些在水中新产生出的氧原子发挥其极强的氧化能力给水杀菌消毒的。铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂原因铁元素转化为Fe(OH)3胶体,使水中悬浮物沉聚, Fe(OH)3胶体微粒直径的范围是__________nm,铁酸钠的电离方程式是。