下列电解质在水溶液中电离方程式错误的是( )
A.NaHCO3===Na++H++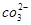 |
B.NaHSO4===Na++H++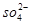 |
| C.MgCl2===Mg2++2Cl- |
| D.Ba(OH)2===Ba2++2OH- |
将下列物质按酸、碱、盐分类顺序排列正确的是
| A.硫酸、纯碱、石膏 | B.氢硫酸、烧碱、绿矾 |
| C.醋酸、乙醇、醋酸钠 | D.磷酸、熟石灰、苛性钾 |
下列各组物质中均属于氧化物的是
| A.SO2、CO、H2O | B.MnO2、NaOH、Fe2O3 |
| C.Fe2O3、Fe3O4、O3 | D.O2、KClO3、H2SO4 |
下列变化属于物理变化的是
| A.O2在放电条件下变成O3 | B.加热胆矾成无水硫酸铜 |
| C.漂白的草帽久置于空气中变黄 | D.用干冰降雨 |
下列关于右图所示装置的叙述正确的是 ( )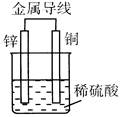
| A.锌是正极 | B.铜片质量逐渐减少 |
| C.铜片表面发生还原反应 | D.电流从锌片经导线流向铜片 |
下列关于氧化物的叙述正确的是
| A.酸性氧化物均可跟碱反应 | B.酸性氧化物一定是非金属氧化物 |
| C.金属氧化物都是碱性氧化物 | D.不能跟酸反应的氧化物一定能跟碱反应 |