某温度下的密闭容器中发生如下反应:2M(g)+N(g)  2E(g),若开始时只充入2 mol E(g),达平衡时,混合气体的压强比起始时增大了20%;若开始时只充入2 mol M和1 mol N的混合气体,则达平衡时M的转化率为
2E(g),若开始时只充入2 mol E(g),达平衡时,混合气体的压强比起始时增大了20%;若开始时只充入2 mol M和1 mol N的混合气体,则达平衡时M的转化率为
| A.20% | B.40% | C.60% | D.80% |
下列化合物分子的核磁共振氢谱中氢原子的吸收峰只有一种的是
| A.CH3OCH3 | B.CH3CH2OH | C.CH3CH2CH3 | D.CH3COCH2CH3 |
下列物质不属于高分子化合物的是
| A.油脂 | B.羊毛 | C.淀粉 | D.橡胶 |
中国科学家许志福和美国科学家穆尔共同合成了世界上最大的碳氢分子。一个该分子含1134个碳原子和1 146个氢原子。下列有关此分子的说法中不正确的是
| A.属于烃类化合物 | B.常温下为固态 |
| C.易燃烧 | D.具有类似金刚石的硬度 |
LiOH是制备锂离子电池的材料,可由电解法制备。工业上利用如图装置电解制备 LiOH,两电极区电解液分别为LiOH和LiCl溶液,下列叙述正确的是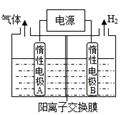
| A.B极区电解液为LiOH溶液 |
| B.电极每产生22.4L气体,电路中转移2mole- |
| C.电解过程中Li+迁移入B电极区、OH-迁移入A电极区 |
D.电解池中总反应方程式为:2HCl 2H2↑+Cl2↑ 2H2↑+Cl2↑ |
等物质的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g)+Y(g)  2Z(g)+W(s)
2Z(g)+W(s)
ΔH<0,下列叙述正确的是
| A.平衡常数K值越大,X的转化率越小 |
| B.若混合气体的平均摩尔质量保持不变,则反应达到平衡 |
| C.达平衡时继续通入气体X,平衡正移则上述ΔH减小 |
| D.升高温度或增大压强都有利于该反应平衡向逆反应方向移动 |