在恒温恒容的密闭容器中,发生反应3A(g)+B(g) xC(g)。
xC(g)。
Ⅰ、将3molA和2molB在一定条件下反应,达平衡时C的体积分数为a;
Ⅱ、若起始时A、B、C投入的物质的量分别为n(A)、n(B)、n(C),平衡时C的体积分数也为a。下列说法正确的是
A、若Ⅰ达平衡时,A、B、C各增加1mol,则B的转化率将一定增大
B、若向Ⅰ平衡体系中再加入3molA和2molB,C的体积分数若大于a,可断定x>4
C、若x=2,则Ⅱ体系起始物质的量应当满足3 n(B) =n(A)+3
D、若Ⅱ体系起始物质的量当满足3 n(C) +8n(A)="=6" n(B)时,可断定x=4
世博会中国馆、主题馆等建筑使用光伏并网发电,总功率达4兆瓦,是历届世博会之最。并且使用半导体(LED)照明,节约大量能源。已知发出白光的LED 是由GaN芯片和钇铝石榴石(YAG,化学式:Y3Al5O12)芯片封装在一起做成的。下列有关叙述正确的是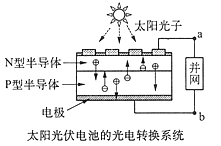
A.光伏电池是将太阳能直接转变为电能
B.图中 N 型半导体为正极, P 型半导体为负极
C.电流从 a 流向 b
D.LED 是新型有机高分子材料
下列图示与对应的叙述相符的是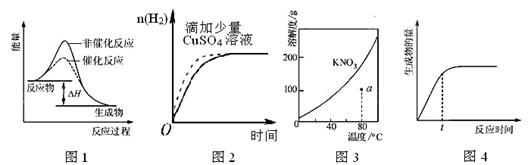
| A.图1 表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| B.图2表示常温下,等量锌粉与足量的等浓度的盐酸反应(滴加CuSO4溶液的为虚线) |
C.图3表示 KNO3 的溶解度曲线,a点所示的溶液是 80℃时 KN O3的不饱和溶液 O3的不饱和溶液 |
| D.图4表示某可逆反应生成物的量随反应时间变化的曲线, t 时反应物转化率最大 |
1mol乙烯与Cl2完全加成,其产物再与Cl2彻底取代,两个过程中共用Cl2
| A.2mol | B.4mol | C.5mol | D.6mol |
已知:CH3CH2CH2CH3(g)+6.5O2(g)→4CO2(g)+5H2O(l),1mol CH3CH2CH2CH3完全燃烧放出 2878 kJ热量;(CH3)2CHCH3(g)+6.5O2(g)→4CO2(g)+5H2O(l),1mol(CH3)2CHCH3燃烧放出2869 kJ热量。下列说法正确的是
| A.1 mol CH3CH2CH2CH3分子储存的能量大于1 mol (CH3)2CHCH3分子 |
| B.1 mol CH3CH2CH2CH3分子储存的能量小于1 mol (CH3)2CHCH3分子 |
| C.(CH3)2CHCH3转化为CH3CH2CH2CH3的过程是一个放热过程 |
| D.断开1 mol物质中化学键吸收的能量CH3CH2CH2CH3大于(CH3)2CHCH3 |
已知 A、B、C、D、E 是短周期中原子序数依次增大的 5种主族元素,其中元素 A、E 的单质在常温下呈气态,元素 B 的原子最外层电子数是其电子层数的 2 倍,元素 C 在同周期的主族元素中原子半径最大,元素 D 的合金是日常生活中常用的金属材料。下列说法正确的是
A.元素 A、B 组成的化合物常温下一定呈气态
B.一定条件下,元素 C、D 的最高价氧化物对应的水化物都是强碱
C .工业上常用电解法制备元素 C、D、E 的单质
.工业上常用电解法制备元素 C、D、E 的单质
D.化合物 AE 与 CE 有相同类型的化学键