已知:2X+Y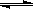 2Z,反应中ω(Z的物质的量分数)随温度T的变化如下图所示。下列判断正确的是
2Z,反应中ω(Z的物质的量分数)随温度T的变化如下图所示。下列判断正确的是
| A.T1时,v正>v逆 |
| B.正反应的△H<0 |
| C.a、b两点的反应速率va=vb |
| D.T<T1时,ω增大的原因是平衡向正方向移动 |
下列对应关系不正确的是
| A.醋、味精——调味品 |
| B.酒精、汽油——易燃液体 |
| C.Na+、Fe3+——人体所需微量元素 |
| D.废塑料瓶、铝制易拉罐——可回收垃圾 |
X、Y、Z、Q、W均为短周期元素,原子序数逐渐增大。X、Q同主族,Q元素的焰色反应为黄色;W的原子半径是同周期中最小的;X与Y、 Z分别形成化合物甲、乙,甲、乙均由10电子分子构成,且能发生反应生成碱。下列说法不正确的是
| A.X的单质和Q的单质均可用电解法得到 |
| B.X与Z可形成同时含有极性键和非极性键的化合物 |
| C.Q与W形成的化合物熔化或溶于水时均可发生电离 |
| D.X、Y、Z三种元素形成的化合物一定能抑制水的电离 |
常温时,下列叙述正确的是
| A.pH=9的NH4Cl与NH3•H2O混合溶液中c(Cl-)>c ) |
| B.pH=2.5的可乐中c(H+) 是pH=3.5的柠檬水中c(H+)的10倍 |
| C.AgCl在0.1mol /L CaCl2溶液和0.1mol/L NaCl溶液中的溶解度相同 |
| D.1 mL 1mol /L Na2CO3溶液加水稀释至100mL, pH和Kw均减小 |
下表中各组物质之间不能通过一步反应实现右图转化的是
| 甲 |
乙 |
丙 |
|
| A |
CH2=CH2 |
CH3CH2Cl |
CH3CH2OH |
| B |
SiO2 |
H2SiO3 |
Na2SiO3 |
| C |
Cl2 |
HCl |
CuCl2 |
| D |
AlCl3 |
Al(OH)3 |
Al2O3 |

下图是研究铁钉腐蚀的装置图,下列说法不正确的是
| A.铁钉在两处的腐蚀速率:a < b |
| B.a、b两处铁钉中碳均正极 |
| C.a、b两处铁钉中的铁均失电子被氧化 |
| D.a、b两处的正极反应式均为O2+4e-+4H+ ===2H2O |