金属卤化物跟卤素化合可生成多卤化物,如:KI+I2 KI3,有关KI3的叙述中不正确的是
KI3,有关KI3的叙述中不正确的是
| A.I2在KI溶液中溶解度增大是由于生成I3-离子 |
B.I3-在溶液中存在下列平衡I3- I2+I- I2+I- |
| C.KI3溶液遇淀粉不变蓝色 |
| D.将Cl2通入KI3溶液中,I3-浓度减小 |
某羧酸的衍生物A的分子式为C6H12O2 ,已知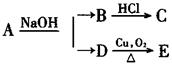 ;又知D不与Na2CO3溶液反应,C和E都不能发生银镜反应,则A的结构可能有()
;又知D不与Na2CO3溶液反应,C和E都不能发生银镜反应,则A的结构可能有()
| A.1种 | B.2种 | C.3种 | D.4种 |
下列叙述中正确的是:()
| A.糖类,氨基酸,蛋白质都是天然高分子化合物 |
| B.利用油脂在酸性条件下水解,可以生产甘油和肥皂 |
| C.淀粉与纤维素分子式都为(C6H10O5)n而结构不同,它们互为同分异构体 |
| D.合成纤维和人造纤维统称化学纤维 |
下列有机物中含有手性碳原子,且与H2发生加成反应后仍含有手性碳原子的是:()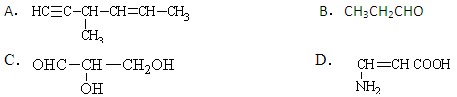
某有机物的结构简式为 ,在一定条件下可能发生的反应有:
,在一定条件下可能发生的反应有:
①加成、②还原、③酯化、④氧化、⑤中和、⑥消去,其中可能的是:()
| A.②③④ | B.①③⑤⑥ | C.①③④⑤ | D.①②③④⑤ |
下列有关除杂质(括号中为杂质)的操作中,错误的是:()
| A.溴苯(溴):加氢氧化钠溶液,充分振荡,分液 |
| B.溴乙烷(乙醇):多次加水振荡,分液,弃水层 |
| C.乙醇(水):利用沸点不同将混合物蒸馏,收集馏出物 |
| D.乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡,分液 |