水的电离平衡为H2O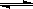 H+﹢OH-,△H>0,下列叙述不正确的是
H+﹢OH-,△H>0,下列叙述不正确的是
| A.将水加热,pH减小 |
| B.恒温下,向水中加入少量固体KOH,Kw不变 |
| C.向水中滴入稀醋酸,c(H+)增大 |
| D.向水中加入少量固体NaClO,平衡逆向移动 |
A元素的阳离子与B元素的阴离子具有相同的电子层结构,有关两种元素有以下叙述:①原子半径A<B ②离子半径A>B ③原子序数A>B ④原子最外层电子数A>B ⑤A的正价与B的负价绝对值不一定相等,其中正确的是
| A.①② | B.③④⑤ | C.③⑤ | D.③④ |
下列叙述错误的是
| A.13C和14C属于同一种元素,它们互为同位素 |
| B.1H和2H是不同的核素,它们的质子数相等 |
| C.14C和14N的质量数相等,它们的中子数不等 |
| D.6Li和7Li的电子数相等,中子数也相等 |
下列有关实验的叙述,正确的是 ___________(填序号)
| A.用NaOH溶液除去乙酸乙酯中混有的乙酸、乙醇,然后分液 |
| B.分馏石油时,温度计的末端必须插入液面下 |
| C.用浓氨水洗涤做过银镜反应的试管 |
| D.配制银氨溶液时,将稀氨水慢慢滴加到稀硝酸银溶液中,产生白色沉淀后继续滴加到沉淀刚好溶解为止 |
E.用分液漏斗分离环己烷和水的混合液体
F.在溴化铁的催化下苯与浓溴水反应制取溴苯
以乙醇为原料,用下述6种类型的反应:①氧化;②消去;③加成;④酯化;⑤水解;⑥加聚,来合成乙二酸乙二酯( )的正确顺序是
)的正确顺序是
| A.①⑤②③④ | B.①②③④⑤ | C.②③⑤①④ | D.②③⑤①⑥ |
迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如图.下列叙述正确的是
| A.迷迭香酸属于芳香烃 |
| B.迷迭香酸可以发生水解反应、取代反应和酯化反应 |
| C.1mol迷迭香酸最多能和9mol氢气发生加成反应 |
| D.1mol迷迭香酸最多能和含5molNaOH的水溶液完全反应 |