天然气的主要成分甲烷燃烧生成二氧化碳和液态水的热化学方程式是:
CH4(g) + 2O2(g) == CO2(g) + 2H2O(l) ΔH="=" -889.6kJ/mol
请回答下列问题:
(1)反应物能量总和________(填“大于”、“小于”或“等于”)生成物能量总和。
(2)若1 mol甲烷完全燃烧生成二氧化碳和水蒸气,则放出的热量 (填“>”、“<”或“=”)889.6kJ。
(3)已知氢气燃烧生成液态水的热化学方程式是:2H2(g)+O2(g) ===2H2O(l) ΔH =-572kJ/mol ,则相同质量的甲烷和氢气,完全燃烧生成液态水,放热较多的是________。
(4)如图所示的装置是由CH4、O2和KOH溶液组成的新型燃料电池,利用该装置可以将 能转化为 能。
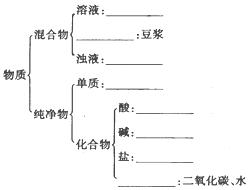
现有下列物质:
| A.豆浆, | B.食盐水, | C.铁, | D.硫酸,E.氢氧化钠固体,F.纯碱,G.泥水,H.二氧化碳,I.水。请将它们的序号或所属类别填充到下列横线上 |
CO和CO2的混合气体18 g,完全燃烧后测得CO2体积为11.2 L(标准状况),
(1)混合气体中CO的质量是 g
(2)混合气体中CO2在标准状况下的体积是 L;
(3)混合气体在标准状况下的密度是 g·L-1。
0.5 mol臭氧(O3)中含有O3的分子数目是,含有O的原子数目是
若某原子的摩尔质量是M g /mol,则一个该原子的真实质量是g
在无土栽培中,配制1 L内含0.5 mol NH4Cl、0.16 mol KCl、0.24 mol K2SO4的某营养液,若用KCl、NH4Cl、(NH4)2SO4配制,则需这三种固体的物质的量分别为、、。