已知I-的结构示意图如图所示,请结合所学知识,
填写下列空白:
(1)X的值为 ;
(2)下列粒子中,与该元素的原子的化学性质相似的是
A B C D
(3)该元素属于 元素。(选填“金属”、“非金属”或“稀有气体” )
蛋白质是构成细胞的基本物质,由多种氨基酸构成,是复杂的相对分子质量巨大的物质。α-丙氨酸是组成人体蛋白质的氨基酸之一,下图是α-丙氨酸的分子结构模型图,据此回答: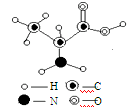
(1)α-丙氨酸属于(填“有机物”或“无机物”)。
(2)α-丙氨酸由种元素组成,其相对分子质量为。
根据下图所示实验,回答下列问题。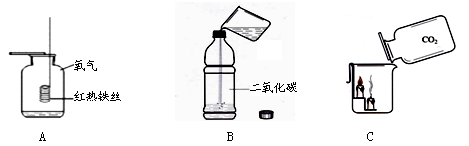
(1)A装置中铁丝没有燃烧的原因(只需答一点)。
(2)B装置中,分别加入相同体积的下列试剂后,迅速拧紧瓶盖并振荡,能使质地较软的塑料瓶变瘪的是(填序号)。
a.水 b.氢氧化钠溶液 c.浓硫酸d.澄清石灰水
(3)C装置中,实验现象为燃着的蜡烛由下至上熄灭,原因为和。
目前,一些发达国家已采用新一代饮用水消毒剂ClO2,请回答下列问题:
(1)ClO2读作。
(2)ClO2分子中氯原子与氧原子的个数比为,其中氧元素的质量分数是。(精确到0.1%)
金属材料在生活、生产中应用非常广泛,请仔细看图并填空: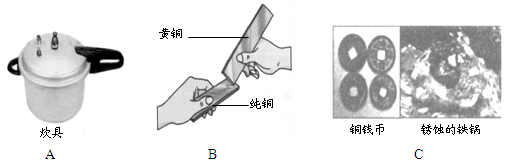
(1)图A主要是利用了金属的性。
(2)图B是用两块金属片相互刻划,观察到在纯铜片上有明显的划痕。该实验探究的目的是。
(3)2010年5月,400多年前的古沉船“南澳一号”成功打捞。图C是古船上部分文物图片,其中可以判断铁比铜活泼的信息是。稀盐酸除锈的化学程式为 :Fe2O3 + 6HCl = 2FeCl3 + 3H2O,该反应的基本类型为。
生活中常用的防锈方法有。
(4)为了比较铁和铜的活动性,小华选用了硫酸铜溶液。请你写出该反应的化学方程式。
化学就在我们身边。现有下列几种物质:乙醇、甲烷、金刚石、石墨、氢氧化钠、熟石灰和合成橡胶,请选择相应的物质填空:
(1)可作为汽车轮胎材料的是。
(2)用于裁玻璃和做饰品的是。
(3)用于改良酸性土壤和配制农药波尔多液的是。
(4)为保护生态环境在农村大力推广使用的沼气,其主要成分是。