25℃,向1LpH = a的NaOH溶液中滴加pH = b的盐酸10L时,刚好完全中和,则(a+b)的值为
| A.13 | B.14 | C.15 | D.12 |
下列有关pH变化的判断中,正确的是
| A.加热盐酸溶液,溶液的pH减小 | B.随温度的升高,纯水的pH增大 |
| C.新制氯水经光照一段时间后,pH减小 | D.NaOH溶液久置于空气中,pH增大 |
常温、常压下饱和CO2溶液的pH为3.9,用已知浓度的盐酸滴定未知浓度的NaHCO3溶液时,应选用的指示剂及滴定终点的颜色变化是
| A.石蕊、由蓝变红 | B.酚酞、红色褪去 |
| C.甲基橙、由橙变黄 | D.甲基橙、由黄变橙 |
pH=2的A、B两种酸溶液各lmL,分别加水稀释到1000 mL,其溶液的pH与溶液体积(V)的关系如图所示,则下列说法正确的是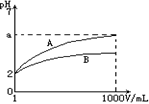
A.A、B溶液浓度一定相等
B.稀释后A溶液酸性比B溶液强
C.a=5时,A是强酸,B是弱酸
D.若A、B都是弱酸,则2<a=5
下列叙述正确的是
| A.常温下pH=12的烧碱和pH=2的盐酸溶液等体积混合,混合液的pH =7 |
| B.pH相同氨水和烧碱溶液稀释相同倍数时,它们的pH仍相同 |
| C.同浓度盐酸中和pH相同的氨水和烧碱溶液, |
| D.向一定量纯水中通入少量HCl气体后,Kw值增大 |