Ⅰ、氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用。回答下列问题:(1)氮元素原子的L层电子数为__________;
(2) NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为_________________________;
(3) 肼-空气燃料电池是一种碱性电池,该电池放电时,正极的反应式为________________________________。
Ⅱ、一定质量的液态化合物XY2在标准状况下的一定质量的O2中恰好完全燃烧,反应方程式为: XY2(l)+3O2 (g) ="==" XO2(g)+2YO2 (g)冷却后,在标准状况下测得生成物的体积是672 mL,密度是2.56g/L则: (1)反应前O2的体积是________。(2)化合物XY2的摩尔质量是___________。
(3)XY2分子中X、Y两元素质量比是3∶16, X、Y两元素分别为__________ (写元素符号)。
(1)下列五组物质,每组中有一种物质从某种分类法的角度分析与其他四种不同,请找出该物质,并说明理由。[例如Fe、S、C、P:Fe(金属)]
①CuSO4、Fe(NO3)3、KMnO4、K2CO3________________;
②AgCl、BaSO4、KNO3、Ca(ClO)2_____________________。这种分类法是________________。
(2)乙醇钠(C2H5ONa)能溶于乙醇,将乙醇钠固体从其乙醇溶液中提取出来的方法是;除去KNO3溶液中的I2杂质,主要操作步骤是。
(3)配制浓度为1:5(98%的浓硫酸和水的体积比)的稀硫酸,需要用到的玻璃仪器有。
(4)臭氧与碘化钾溶液反应的化学方程式为:O3+2KI+H2O==O2+2KOH +I2;其中还原产物与氧化产物物质的量之比是,若有0.5mol氧气生成,电子转移总数为。
通过海水晾晒可得粗盐。粗盐除NaCl外,还含有MgCl2、CaCl2以及泥沙等杂质。为了有效将粗盐提纯,实验的各步操作流程如下图所示。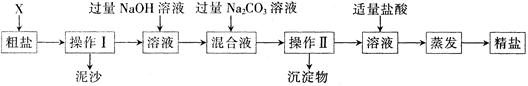
根据以上信息回答:
(1)在完成操作Ⅰ之前,必须加入的X物质是。
(2)操作Ⅰ和操作Ⅱ的名称是。该操作中需要将圆形滤纸折叠处理,下列图示中不该出现的情形是(填序号)。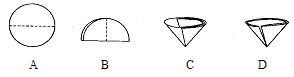
(3)在蒸发操作中容易造成食盐固体飞溅,为尽量减少飞溅,除连续搅拌外还可采取等措施。
(4)在实验过程中加入过量的NaOH溶液,其实验目的是。
(5)判断加入的盐酸“适量”的方法是。
(6)实验所得精盐的质量_________(填“大于”、“小于”或“等于”)粗盐中NaCl的质量,原因是。
(1)下列物质能导电的是,属于电解质的是,属于非电解质的是。
①NaCl晶体②液态SO2③液态醋酸④汞⑤BaSO4固体
⑥纯蔗糖(C12H22O11)⑦氨水⑧熔化的KNO3
(2)按要求写出下列方程式:
①KHSO4熔融状态电离方程式:
②小苏打与过量石灰乳反应的离子方程式:
(3)①36g重水(2H2O)中氧原子的物质的量为: _________________。
②在同温同压下,相同体积的O2和CH4,原子数目之比为______________。
③含有6.02×1023个氦原子的氦气在标准状况下的体积约为。
(4)同温同压下,某容器充满O2重96 g,若充满CO2重102 g,现充满某气体重104 g,则某气体的摩尔质量为 。
(1)已知某温度时,Ksp[Mg(OH)2]=4.0×10-11,Kw=1.0×10-13。在0.01 mol·L-1的MgCl2溶液中,逐滴加入NaOH溶液,当Mg2+完全沉淀时,溶液的pH是(已知lg2=0.3)
(2)已知Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.6×10-12,现在向0.001 mol·L-1 K2CrO4和0.01 mol·L-1 KCl混合液中滴加0.01 mol·L-1 AgNO3溶液,刚出现Ag2CrO4沉淀时,溶液中c(Cl-)=。(设混合溶液体积不变)
熔融盐燃料电池具有较高发电效率,因而受到重视。某燃料电池以熔融的K2CO3(其中不含O2-和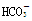 )为电解质,以丁烷为燃料,空气为氧化剂,具有催化作用和导电性能的稀土金属材料为电极。该电池负极反应式为:2C4H10+
)为电解质,以丁烷为燃料,空气为氧化剂,具有催化作用和导电性能的稀土金属材料为电极。该电池负极反应式为:2C4H10+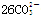 -52e- =34CO2+10H2O。试回答下列问题:
-52e- =34CO2+10H2O。试回答下列问题:
(1)正极电极反应式为_______________。
(2)为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此,必须在通入的空气中加入一种物质,加入的物质是,它来自。
(3)某学生想用该燃料电池和如图所示装置来电解饱和食盐水:
①写出反应的离子方程式________________________。
②将湿润的淀粉KI试纸放在该装置附近,发现试纸变蓝,待一段时间后又发现蓝色褪去,这是因为过量的Cl2将生成的I2氧化。若反应的Cl2和I2的物质的量之比为5∶1,且生成两种酸。该反应的化学方程式为_________________。
③若电解后得200 mL 3.25 mol·L-1 NaOH溶液,则消耗C4H10体积在标况下为________mL。