氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。下列反应与Br2+SO2+2H2O=H2SO4+2HBr相比较,水的作用不相同的是
| A.2Na2O2+2H2O=4NaOH+O2↑ | B.4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
| C.Cl2+H2O=HCl+HClO | D.2Al+2NaOH+2H2O=2NaAlO2+3H2↑ |
将标准状况下的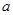 LHCl(g)溶于1000g水中,得到的盐酸密度为bg·cm-3,则该盐酸的物质的量浓度是
LHCl(g)溶于1000g水中,得到的盐酸密度为bg·cm-3,则该盐酸的物质的量浓度是
A.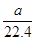 mo1·L-1 mo1·L-1 |
B.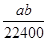 mol·L-1 mol·L-1 |
C.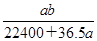 mol·L-1 mol·L-1 |
D.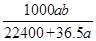 mol·L-1 mol·L-1 |
下列说法正确的是:
| A.22.4LN2中一定含有6.02×1023个氮分子 |
| B.1LH2O中溶解了0.5molNaCl,则该溶液的物质的量浓度为0.5mol/L |
| C.从1L1mol/LC12H22O11溶液中取出10mL,则取出的10mL溶液物质的量的浓度仍为1mol/L |
| D.1LH2SO4溶液中含有98g H2SO4,则该溶液的物质的量浓度为98g/L |
用合适的容量瓶配制480mL1.0 mol·L-1NaNO2溶液时,需称取溶质质量为
| A.13.8g | B.69g | C.34.5g | D.33.1g |
在标准状况下CH4、HCl、H2S、NH3均为气体。在标准状况下分别有①13.44L CH4 ②1molHCl分子 ③27.2gH2S ④2.408×1023个NH3分子,下列说法正确的是
| A.体积:②>③>④>① | B.密度:②>③>①>④ |
| C.质量:②>③>④>① | D.H原子个数:①>③>④>② |
过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得食盐水:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2 溶液;④滴入稀盐酸至无气泡产生;⑤过滤;正确的操作顺序是
| A.③②①⑤④ | B.①②③⑤④ | C.②③①④⑤ | D.③⑤②①④ |