在101kPa和25°C时,有关反应的热化学方程式如下:
C(s)+1/2 O2(g)=CO(g) △H1= -110.5KJ/mol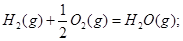
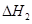 =
=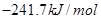
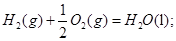
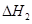 =
=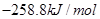
下列说法正确的是( )
A.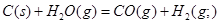 ; ;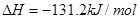 |
B.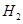 燃烧热的化学方程式为: 燃烧热的化学方程式为: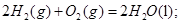 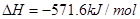 |
C.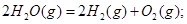 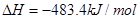 |
D.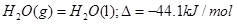 |
已知:
根据以上热化学方程式判断,下列说法正确的是( )
| A. | 的燃烧热为283 |
| B. | 上图可表示由 生成 的反应过程和能量关系 |
| C. | |
| D. | 与 反应放出509 热量时,电子转移数为2×6.02×10 23 |
已知:
现有 与 的混合气体112 (标准状况),使其完全燃烧生成 和 ,若实验测得反应放热3695 ,则原混合气体中 与 的物质的量之比是( )
| A. | 1∶1 | B. | 1∶3 | C. | 1∶4 | D. | 2∶3 |
一定条件下,用甲烷可以消除氮氧化物(NOx)的污染。已知:
① CH4 (g)+4NO2 (g)="4NO" (g) +CO2 (g)+2H2O (g)△H=―574 kJ·mol-1
② CH4 (g)+4NO (g)=2N2 (g)+CO2 (g)+2H2O (g)△H=―1160 kJ·mol一1
下列选项正确的是()
| A.CH4 (g)+2NO2 (g)= N2 (g)+CO2 (g)+2H2O (l) ;△H=―867 kJ·mol-1 |
| B.若0.2 mol CH4还原NO2至N2,在上述条件下放出的热量为173.4 kJ |
| C.CH4催化还原NOx为N2的过程中,若x=1.6,则转移的电子为3.2 mol |
| D.若用标准状况下2.24L CH4还原NO2至N2,整个过程中转移的电子为1.6 mol |
在同温同压下,下列各组热化学方程式中△H1>△H2的是()
| A.2H2(g)+ O2(g)="=" 2H2O(l);△H1 2H2(g)+ O2(g)="=" 2H2O(g);△H2 |
| B.2S(g)+ O2(g) ="=" 2SO2(g);△H1 2S(s)+ O2(g) ="=" 2SO2(g);△H2 |
| C.C(s)+1/2O2(g)="=" CO(g);△H1C(s)+ O2(g)="=" CO2(g);△H2 |
| D.H2(g)+ Cl2(g)="=" 2HCl(g);△H11/2H2(g)+ 1/2Cl2(g)="=" HCl(g);△H2 |
已知:CH4(g)+2O2(g)→CO2(g)+2H2O(g)ΔH=-Q1 kJ/mol;
2H2(g)+O2(g) ==2H2O(g)ΔH=-Q2 kJ/mol;
H2O(g) ==H2O(l)ΔH=-Q3 kJ/mol
常温下取体积比为4:1的甲烷和H2的混合气体112L(标准状况下),经完全燃烧后恢复到常温,则放出的热量为( )
| A.4Q1+0.5Q2 | B.4Q1+Q2+10Q3 | C.4Q1+2Q2 | D.4Q1+0.5Q2+9Q3 |