下列事实不能用勒夏特列原理解释的是( )
A.溴水中有下列平衡Br2+H2O HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅 HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅 |
| B.合成氨反应,为提高氨的产率,理论上应采取降低温度的措施 |
C.反应CO(g)+NO2(g) CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深 CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深 |
D.对于2HI(g) H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深 H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深 |
X、Y、Z均为短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为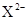 和
和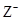 ,Y+和
,Y+和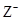 具有相同的电子层结构。下列说法正确的是
具有相同的电子层结构。下列说法正确的是
| A.原子的最外层电子数:X>Y>Z | B.单质沸点:X>Y>Z |
C.离子半径: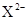 > Y+> > Y+>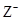 |
D.原子序数:X>Y>Z |
反应:2SO2+O2 2SO3,经过一段时间后, SO3的浓度增加了0.4mol/L,在这段时间内用O2表示的反应速率为0.04mol/(L·S),则这段时间为
2SO3,经过一段时间后, SO3的浓度增加了0.4mol/L,在这段时间内用O2表示的反应速率为0.04mol/(L·S),则这段时间为
| A.0.1S | B.2.5S | C.5S | D.10S |
碱性电池具有容量大、放电电流大的特点,因而得到广泛使用,锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应为:ZN(s)+2MNO2(s)+H2O(l)﹦ZN(OH)2(s)+MN2O3(s)。下列说法错误的是
| A.电池工作时,锌失去电子 |
| B.电池正极的电极反应式为:2MNO2(s)+H2O(l)+2e-﹦MN2O3(s)+2OH-(aq) |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
下列关于碱金属铷(Rb)的叙述正确的是
| A.它位于周期表的第四周期第IA族 |
| B.氢氧化铷是弱碱 |
| C.在钠、钾、铷三种单质中,铷的熔点最高 |
| D.硝酸铷是离子化合物 |
下表为部分短周期元素的原子半径及主要化合价,根据表中信息判断,下列叙述正确的是
| 元素代号 |
X |
Y |
Z |
M |
N |
| 原子半径/Nm |
0.160 |
0.143 |
0.102 |
0.071 |
0.099 |
| 主要化合价 |
+2 |
+3 |
+6、-2 |
-1 |
-1 |
A.X、Y最高价氧化物对应水化物的碱性:Y>X
B.M、N形成的简单离子的还原性:N->M-
C.气态氢化物的稳定性:HM<H2Z
D.最高价氧化物对应的水化物的酸性:H2ZO4>HNO4