火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态过氧化氢(H2O2)。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。
又知H2O(l)=H2O(g) ΔH=+44kJ/mol。
(1)写出过氧化氢(H2O2)的结构式 。
(2)液态肼与液态过氧化氢反应生成液态水反应的热化学方程式为 。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是______ 。
【改编】(每空2分,共12分)下面A~F是几种常见烃的分子球棍模型。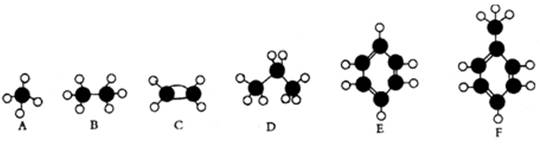
根据上述模型,回答下列问题:
(1)常温下含碳量最高的液态烃是 。
(2)能够发生加成反应的烃有 种。
(3)写出E与液溴在FeBr3催化下反应的方程式: ,反应类型:
(4)所有原子均在同一平面上的是 。
(5)能使酸性高锰酸钾溶液褪色的是 (填对应字母)。
某芳香烃0.1 mol在足量氧气中完全燃烧后,将生成的产物依次通过浓硫酸和NaOH溶液,测得浓硫酸增重9.0g,NaOH溶液增重35.2g。
(1)该有机物的分子式(写出推算过程)。
(2)该有机物有_________种同分异构体,它们的结构简式分别为:________________;
(3)其中一种同分异构体苯环上的一溴代物只有一种结构,其名称为______________。
还有一种同分异构体被酸性KMnO4溶液氧化后可以得到一种芳香酸,该芳香酸1mol能中和2molNaOH,且该有机物的一氯取代物有3种结构,则该烃有机物的结构简式是: 。
A、B是相对分子质量不相等的两种烃,无论二者以何种比例混合,只要混合物的总质量不变,完全燃烧后所产生的CO2的质量就不变。
(1)试写出两组符合上述情况的烃的结构简式:
________________和________________;
________________和________________。(与第一组的物质类别不同)
(2)A、B应满足的条件是_____________________________________________。
(每空2分,共10分)有A、B、C三种有机物,结构简式如下图所示,试回答有关问题: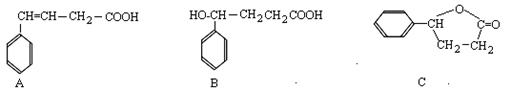
(1)A与C的关系为 。
(2)A→B的反应类型为 。
(3)B→C的化学方程式为 。
(4)1mol A与足量H2发生反应,最多消耗 mol H2;A经加聚反应所得聚合物的结构简式为 。
【原创】现有A、B、C、D、E五种金属片,①把A、C用导线连接后同时浸入稀硫酸铜溶液中,A上有红色固体产生;②把C、D用导线连接后同时浸入稀硫酸溶液中,D发生氧化反应;③把A、B 用导线连接后同时浸入稀硫酸溶液中,电流方向为B→导线→A;④将E放入水中,立即有气体产生。根据上述情况,回答下列问题:
(1)在①中,金属片_______发生氧化反应;
(2)在②中,金属片_______作负极;
(3)如果把B、D用导线连接后同时浸入稀硫酸溶液,则金属片_______上有气泡产生;
(4)上述五种金属的活动性顺序是__________________。