下列对价电子构型为2s22p5的元素描述正确的是( )
| A.原子半径最小 | B.非金属性最强 |
| C.第一电离能最大 | D.电负性最大 |
2 mol的PCl3和1 mol的Cl2混合后充入容积不变的密闭容器中,在一定条件下发生反应: PCl3(g)+Cl2(g) PCl5(g),达到平衡时,PCl5为0.4 mol。如果此时移走1 mol PCl3 和0.5 mol Cl2,在相同温度下再次达到平衡时,PCl5的物质的量()
PCl5(g),达到平衡时,PCl5为0.4 mol。如果此时移走1 mol PCl3 和0.5 mol Cl2,在相同温度下再次达到平衡时,PCl5的物质的量()
| A.等于0.4 mol | B.等于0.2 mol | C.小于0.2 mol | D.大于0.2 mol |
在指定环境中可能大量共存的离子组是
| A.在c(H+)=1.0×10-13 mol·L-1的溶液中:Na+、S2-、AlO2-、SO32- |
| B.在由水电离出的c(H+)=1×10-12 mol/L的溶液中:Fe2+ NO3- Na+ SO42- |
| C.使甲基橙变红的溶液中:NH4+、K+、ClO-、Cl- |
| D.与Al反应只放出H2的溶液中:K+、Cu2+、Cl-、NO3- |
一定温度下,两个恒容密闭容器中分别发生反应:] ①H2(g)+I2(g) 2HI(g);②C(s)+H2O(g)
2HI(g);②C(s)+H2O(g) CO(g)+H2(g),下列状态能表明两反应都达到平衡状态的是
CO(g)+H2(g),下列状态能表明两反应都达到平衡状态的是
a.各物质的浓度不变;
b.容器内气体压强不变;
c.容器内气体密度不变;
d.容器内气体颜色不变;
e.各组分的物质的量分数或质量分数不变;
f.混合气体的平均分子量不变;
| A.ae | B.aef | C.abc | D.ac |
可逆反应aA(s)+bB(g) cC(g)+dD(g)进行过程中,当其他条件不变时,C的体积分数C%与温度(T)、压强(p)的关系如下图所示。下列叙述正确的是
cC(g)+dD(g)进行过程中,当其他条件不变时,C的体积分数C%与温度(T)、压强(p)的关系如下图所示。下列叙述正确的是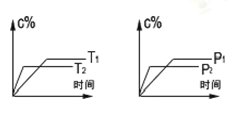
| A.达到平衡后,加入催化剂,C的体积分数增大 |
| B.达到平衡后,升高温度,平衡向左移动 |
| C.化学方程式中,b>c+d[ |
| D.达到平衡后,增加A的量,平衡向右移动 |
在容积为2 L的密闭容器中充入2 mol SO2和一定量O2,发生反应2SO2+O2 2SO3,当反应进行到4 min时,测得n(SO2)=0.4 mol。则反应进行到2 min时,容器中SO2的物质的量是
2SO3,当反应进行到4 min时,测得n(SO2)=0.4 mol。则反应进行到2 min时,容器中SO2的物质的量是
| A.等于1.6 mol | B.等于1.2 mol | C.大于1.6 mol | D.小于1.2 mol |