下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。
| a |
|
b |
|||||||||||||||
| |
|
|
|
|
|
|
|
|
|
|
|
|
c |
d |
|
|
|
| e |
f |
g |
h |
|
|
i |
|
||||||||||
| |
|
|
|
|
|
|
|
j |
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)j是钴元素,试画出该元素的原子结构示意图 。
(2)c、d原子半径大小c d,第一电离能大小关系是c d,电负性大小关系是c d。(以上填“>”” “<”)
(3)已知NH3·H2O的电离方程式为NH3·H2O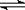 NH4++OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构是____ __ (填序号) 。
NH4++OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构是____ __ (填序号) 。
(4)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚面离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
①原子核对核外电子的吸引力 ②形成稳定结构的倾向
下表是一些主族元素的气态原子失去核外不同电子所需的能量(KJ·mol-):
| |
锂 |
X |
Y |
| 失去第一个电子 |
519 |
502 |
580 |
| 失去第二个电子 |
7296 |
4570 |
1820 |
| 失去第三个电子 |
11799 |
6920 |
2750 |
| 失去第四个电子 |
|
9550 |
11600 |
表中X、Y可能分别为以上元素中的 、 (填写元素符号)元素。
有5 种短周期元素的原子序数按E、D、B、A、C的顺序依次增大;A、C同周期,B、C同主族;A与B可形成离子化合物A2B,A2B中所有粒子的电子数相同,且电子总数为30;D和E可形成4核10电子的分子。试回答下列问题:
(1)写出五种元素的名称:ABCD。
(2)用电子式表示离子化合物A2B的形成过程:
(3)写出下列物质的电子式:
D元素形成的单质;B与E形成的化合物;
A、B、E形成的化合物;D、E形成的化合物。
如图所示装置
(1)若烧杯中溶液为稀硫酸,则观察到的现象为。两极反应式为:正极;负极。
该装置将能转化为能。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为,
总反应方程为。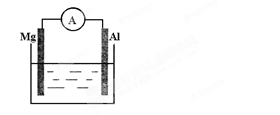
指出下列变化能量是怎样转化的:
(1)学校燃烧煤煮饭,
(2)给手机的电池充电,
(3)用畜电池点亮灯泡,
(4)电解水得到O2和H2。
在原子序数1—18号元素中:
(1)与水反应最剧烈的金属是_____________。
(2)与水反应最剧烈的非金属单质是_____________。
(3)气态氢化物水溶液呈碱性的元素是_____________。
(4)气态氢化物最稳定的化学式是_____________。
(5)最高价氧化物对应水化物的酸性最强的元素是_____________。
现有mg某气体X2,它的摩尔质量为Mg·mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为 mol。
(2)该气体所含原子总数为 个。
(3)该气体在标准状况下的体积为 L。
(4)该气体溶于水后形成V L溶液,其溶液的物质的量浓度是 。