甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
① CH3OH(g)+H2O(g)===CO2(g)+3H2(g);ΔH=+49.0 kJ/mol
② CH3OH(g)+ O2(g)===CO2(g)+2H2(g);ΔH=-192.9 kJ/mol
O2(g)===CO2(g)+2H2(g);ΔH=-192.9 kJ/mol
下列说法正确的是 ( )
| A.CH3OH的燃烧热为192.9 kJ/mol |
B.反应①中的能量变化如图所示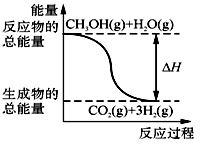 |
| C.CH3OH转变成H2的过程一定要吸收能量 |
D.根据②推知反应:CH3OH(l)+ O2(g)===CO2(g)+2H2(g)的ΔH>-192.9 kJ/mol O2(g)===CO2(g)+2H2(g)的ΔH>-192.9 kJ/mol |
下列选项中有关离子方程式的书写正确的是( )
| A.过氧化钠固体与水反应:2O22-+2H2O=4OH-+O2↑ |
| B.H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| C.过量的CO2通入Ca(ClO)2溶液中:ClO-+CO2+H2O=HCO3-+HClO |
| D.硫化钠水溶液呈碱性的原因:S2-+2H2O=H2S+2OH- |
下列装置、试剂选用或操作正确的是( )
| A.除去NO中的NO2 | B.用于AlCl3蒸发结晶 | C.稀释浓硫酸 | D.制备少量O2 |
现向一密闭容器中充人物质的量浓度均为0. 10 mol/L的CH4和CO2,一定条件下发生反应:CH4(g)+CO2( g)=2CO(g)+2H2 (g)△H,测得CH4的平衡转化率与温度及压强的关系如图所示。下列说法不正确的是
| A.△H>0 |
| B.1000℃,P3条件下,在Y点:v(正)<v(逆) |
| C.P4>P3>P2>Pl |
| D.1100℃,P4条件下该反应的平衡常数K="l." 64(mol/L)2 |
电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点。右图是某同学用0.1 mol/L KOH溶液分别滴定体积均为20 mL、浓度均为0.1 mol/L的HC1和CH3 COOH溶液滴定曲线示意图。下列有关判断正确的是
| A.曲线①代表0.1 mol/L KOH溶液滴定HC1溶液的滴定曲线,曲线②代表0.1 mol/LKOH溶液滴定CH3 COOH溶液的滴定曲线 |
| B.在相同温度下,C点水电离的c(H+)等于A点水电离的c(H+) |
| C.在A点的溶液中有:c(CH3COO-)+c(OH-)-c(H+)="0.1" mol/L |
| D.在B点的溶液中有:c(K+)>c(OH-)>c(CH3COO-)>c(H+) |
短周期主族元素A、B、C、D的原子序数依次增大,并且A、B、C原子的最外层电子数之和为14,B、C、D位于同一周期,C原子的最外层电子数既是A原子内层电子数的3倍又是B原子最外层电子数的3倍。下列说法正确的是
A.原子半径:C>B>A
B.A与其它3种元素均能形成共价化合物
C.室温下,A、C、D的最简单氢化物溶于水形成的水溶液pH都小于7
D.元素B、C、D各自最高和最低化合价的代数和分别为2、4、6