常温时,将pH为5的HCl溶液与pH为2的HCl溶液等体积混合后,溶液的氢氧根离子浓度最接近于( )
| A.2×10-12mol/L | B.1/2(10-9+10-12)mol/L |
| C.(10-9+10-12)mol/L | D.1/2(10-5+10-2) |
下列说法中正确的是
| A.常温下,稀释0.1 mol/L的氨水,溶液中c(OH-)、c(NH4+)、c(H+)均下降 |
| B.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| C.常温下,c(NH4+)相等的①(NH4)2SO4②(NH4)2Fe(SO4)2③NH4Cl ④(NH4)2CO3溶液中,溶质物质的量浓度大小关系是:②<①<④<③ |
| D.当溶液中存在的离子只有Cl-、OH-、NH4+、H+时,该溶液中离子浓度大小关系可能为c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
某密闭容器中充入等物质的量的气体A和B,一定温度下发生如下反应:A(g)+xB(g) 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间的变化关系如图所示。下列说法中正确的是
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间的变化关系如图所示。下列说法中正确的是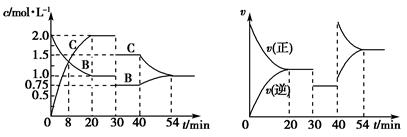
| A.8 min时表示正反应速率等于逆反应速率 |
| B.前20 min A的反应速率为0.05 mol/(L·min) |
| C.反应方程式中的x=1,30 min时表示增大压强 |
| D.40 min时改变的条件是升高温度,且正反应为吸热反应 |
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ/mol
②CH3OH(g)+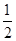 O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ/mol
O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ/mol
下列说法正确的是
| A.CH3OH的燃烧热为192.9 kJ/mol |
| B.反应①中的能量变化如上图所示 |
| C.CH3OH转变成H2的过程一定要吸收能量 |
D.根据②推知反应CH3OH(l)+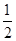 O2(g)===CO2(g)+2H2(g)的ΔH>-192.9 kJ/mol O2(g)===CO2(g)+2H2(g)的ΔH>-192.9 kJ/mol |
已知室温时,0.1mol/L某一元酸HA的pH=4,下列说法正确的是
| A.HA在水中有0.001%发生电离 |
| B.HA的电离平衡常数K=10-8mol/L |
| C.升高温度时,PH增大 |
| D.由HA电离出的c(H+)约为水电离出的c(H+)的106倍。 |
下列说法中正确的是
| A.中和热的测定实验中需要用的主要玻璃仪器有:两个大小相同的烧杯、两个大小相同的量筒、温度计、环形玻璃搅拌棒 |
| B.可以用保温杯来代替烧杯做有关测定中和热的实验 |
| C.在测定中和热的实验中,至少需要测定并记录温度的次数是3次 |
| D.测定中和热实验中,若所使用的稀NaOH溶液的物质的量稍大于稀盐酸,则会导致所测得的中和热数值偏高 |