下列说法正确的是
| A.乙酸与乙醇的混合液可用分液漏斗进行分离 |
| B.将金属钠在研钵中研成粉末,使钠与水反应的实验更安全 |
| C.钢铁表面烤蓝生成一层致密的Fe3O4,能起到防腐蚀作用 |
| D.用标准盐酸滴定待测NaOH溶液,水洗后的酸式滴定管未经标准液润洗,则测定结果偏低 |
用如图装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是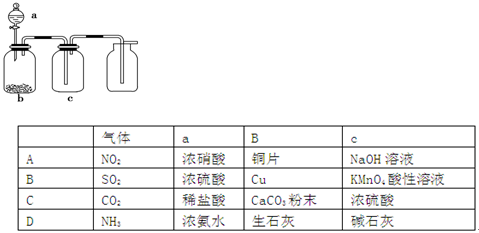
一定浓度的硝酸与Cu2S反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O。当产物中n(NO2)∶n(NO)=1∶1时,下列说法正确的是( )
| A.产物中n[Cu(NO3)2]∶n(CuSO4)=1∶1 |
| B.参加反应的n(Cu2S)∶n(HNO3)=1∶5 |
| C.反应中Cu2S既作氧化剂,又作还原剂 |
| D.1 mol Cu2S参加反应时有8 mol电子转移 |
短周期元素X、Y、Z、W在元素周期表中的相对位置如右下图所示,其中X所处的周期序数与族序数相等。下列判断错误的是
| A.四种元素最高价氧化物对应的水化物均能与NaOH溶液反应 |
| B.气态氢化物的稳定性:Y<W |
| C.原子半径:Y>Z |
| D.含X的盐溶液一定显酸性 |
下列装置或操作能达到实验目的的是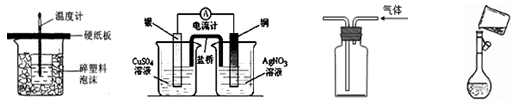
| A.中和热测定 | B.构成原电池 | C.收集氢气 | D.定容 |
下列实验“操作和现象”与“结论”都正确的是
| 操作和现象 |
结论 |
|
| A |
切开金属钠,钠表面的银白色会逐渐褪去 |
Na在空气中会生成Na2O2 |
| B |
铝箔插入浓硝酸中,无明显现象 |
铝与浓硝酸不反应 |
| C |
SO2通入酸性KMnO4溶液,溶液褪色 |
SO2具有漂白性 |
| D |
将充满NO2的试管倒立在水中,试管内液面约上升至试管容积的2/3处;缓慢通入O2,轻轻晃动试管,至液体基本上充满试管 |
从原料的充分利用和减少污染物的排放等方面考虑,该实验对工业生产硝酸有重要启示 |