下列说法中,正确的是( )
| A.△H>0表示放热反应,△H<0表示吸热反应 |
| B.M与N是同素异形体,由M=N;△H=+119KJ/mol可知,M比N稳定 |
| C.l mol H2SO4与1mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热 |
| D.1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热 |
如图所示装置,均盛有等体积等浓度的稀硫酸,工作相同的时间后测得均通过n mol e-。下列叙述错误的是(不考虑溶液体积的变化)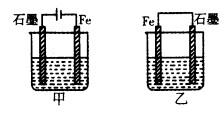
| A.铁棒的腐蚀程度:甲<乙 |
| B.碳电极上发生反应的电极反应式相同 |
| C.溶液的pH:甲减小,乙增大 |
| D.甲乙产生气体的体积(相同条件)比为3:2 |
下列表示对应化学反应的离子方程式正确的是
A.硫化钠溶于水中:S2-+2H2O H2S+2OH- H2S+2OH- |
| B.醋酸溶解鸡蛋壳:2CH3COOH+CaCO3=Ca2++2CH3COO-+CO2↑+ H2O |
| C.NaHCO3溶液与稀H2SO4反应:CO32-+2H+=H2O+CO2↑ |
| D.NH4HCO3溶液与足量的NaOH溶液反应:HCO3-+OH-=CO32-+H2O |
下列有关热化学方程式的叙述正确的是
| A.已知2H2(g)+O2(g) = 2H2O(g);△H=-483.6kJ/mol,则氢气的燃烧热为241.8KJ/mol |
| B.已知4P(红磷,s)= P4(白磷,s);△H>0,则白磷比红磷稳定 |
C.含20.0g NaOH的稀溶液与稀硫酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(ag)+ H2SO4(ag)= H2SO4(ag)=  Na2SO4(ag)+H2O(l);△H=-57.4kJ/mol Na2SO4(ag)+H2O(l);△H=-57.4kJ/mol |
D.己知C(s)+ O2(g)= CO2(g);△H1C(s)+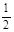 O2(g)= CO(g);△H2则△H1>△H2 O2(g)= CO(g);△H2则△H1>△H2 |
下列实验操作或对实验事实的叙述中存在错误的是
| A.用50mL酸式滴定管准确量取23.20mL酸性KMnO4溶液,放入锥形瓶中待用 |
| B.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法 |
| C.酸碱中和滴定时,锥形瓶未用待装液润洗。 |
| D.用惰性电极电解NaCl溶液,一段时间后,再加盐酸,可使溶液与原溶液完全一样。 |
下列事实中,不能用勒沙特列原理来解释的是
| A.除去CuCl2溶液中的Fe3+,通常是向其中加入CuO、Cu(OH)2等固体 |
B.对于反应H2(g)+I2(g) 2HI(g),增大平衡体系的压强(压缩体积),可使体系颜色变深 2HI(g),增大平衡体系的压强(压缩体积),可使体系颜色变深 |
| C.AgCl在水中的溶解度大于在饱和NaCl溶液中的溶解度 |
| D.在Na2CO3溶液中,由水电离出的c(OH-) >1×10-7mol/L |