可逆反应aA(s)+2 B(g)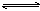 2C(g)+D(g),其中a为正整数。反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是( )
2C(g)+D(g),其中a为正整数。反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是( ) 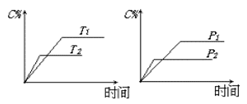
| A.达到平衡后,加入催化剂则C%增大 |
| B.达到平衡后,若升高温度,平衡向右移动 |
| C.a可以为任意的正整数 |
| D.达平衡后,增加A的量,有利于平衡向右移动 |
下列对下图所示装置实验现象的描述正确的是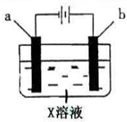
| a电极 |
b电极 |
x溶液 |
实验现象 |
|
| A |
Fe |
石墨 |
NaCl |
a极质量减小,b极放出无色气体 |
| B |
Fe |
石墨 |
KNO3 |
a极质量增加,b极放出无色气体 |
| C |
Fe |
Cu |
CuSO4 |
a极质量增加,b极质量减少 |
| D |
石墨 |
石墨 |
HCl |
a、b极都放出无色气体 |
1L 0.1mol/L的AgNO3溶液在以Ag作阳极,Fe作阴极的电解槽中电解,当阴极上增重2.16g时,下列判断正确的是
| A.电解质AgNO3溶液的浓度变为0.08mol/L |
| B.阳极上产生112mLO2(标况) |
| C.转移1.204×1022个电子 |
| D.反应中有0.01mol的Ag被氧化 |
以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Au等杂质)的电解精炼,下列说法正确的是
| A.利用阳极泥可回收Ag、Au等金属 |
| B.阳极减少的质量一定等于阴极增加的质量 |
| C.精炼过程中,CuSO4溶液的浓度不发生改变 |
| D.因部分电能转化为热能,精炼时通过的电量与阴极铜的析出量无确定关系 |
有关下图的说法正确的是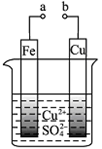
| A.构成原电池时溶液中SO42-移向Cu极 |
| B.构成原电池时Cu极反应为:Cu﹣2e-===Cu2+ |
| C.构成电解池时Fe极质量既可增也可减 |
| D.a和b分别接直流电源正、负极,Fe极会产生气体 |
下列叙述中,不符合生产实际的是
| A.电解法精炼铜,用纯铜做阴极 |
| B.电解熔融的氧化铝制取金属铝,用铁做阳极 |
| C.电解饱和食盐水,用碳网做阴极 |
| D.在镀件上镀锌,用锌做阳极 |