体积相同的甲、乙两个容器中,分别充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2 2SO3并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为( )
2SO3并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为( )
| A.等于p% | B.大于p% | C.小于p% | D.无法判断 |
下列物质中因化学反应而使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色的是
①C5H10(环戊烷) ②CH3C≡CCH3③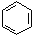
④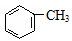 ⑤CH2=CHCHO⑥
⑤CH2=CHCHO⑥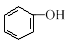 水溶液
水溶液
| A.①③ | B.①③④ | C.①④⑤ | D.②⑤⑥ |
近年来媒体多次报道了数起因食用有“瘦肉精”的猪肉和内脏,而发生急性中毒的恶性事件。这足以说明,目前由于奸商的违法经营,已使“瘦肉精”变成了“害人精”。“瘦肉精”的结构可表示为: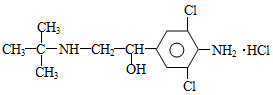
下列关于“瘦肉精”的说法中正确的是
| A.属于芳香烃 | B.分子式为C12H19Cl3N2O |
| C.摩尔质量为313.5 g | D.不能发生消去反应 |
下列离子方程式与所述事实相符且正确的是
| A.向苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- |
| B.用醋酸除去水垢:CaCO3 + 2H+=Ca2+ + H2O + CO2↑ |
| C.用稀硝酸清洗银镜反应实验后的试管:3Ag+4H++NO3-=3Ag++NO↑+2H2O |
| D.钠和冷水反应:Na+2H2O=Na++2OH-+H2↑ |
某有机物的分子结构如图(图中棍表示单键、双键或叁键),它属烃的含氧衍生物。关于该有机物的叙述正确的是
| A.该有机物的化学式为C6H6 |
| B.该有机物可发生取代反应和加成反应 |
| C.该有机物可使溴水褪色,但不能与NaOH溶液反应 |
| D.该有机物是乙酸的同系物 |
绿色化学提倡化工生产应提高原子利用率。原子利用率表示目标产物的质量与生成物总质量之比。在下列制备环氧乙烷的反应中,原子利用率最高的是
A. |
B. |
C. |
D. |