在一恒温恒容密闭容器中,A、B气体可建立如下平衡:2A(g)+2B(g) C(g)+3D(g)现分别从两条途径建立平衡:I.A、B的起始量均为2mol;Ⅱ.C、D的起始量分别为2mol和6mol。下列叙述不正确的是: ( )
C(g)+3D(g)现分别从两条途径建立平衡:I.A、B的起始量均为2mol;Ⅱ.C、D的起始量分别为2mol和6mol。下列叙述不正确的是: ( )
A.I、Ⅱ两途径最终达到平衡时,体系内混合气体的百分组成相同
B.I、Ⅱ两途径最终达到平衡时,体系内混合气体的百分组成不同
C.达到平衡时,途径I的和途径Ⅱ体系内混合气体平均相对分子质量相同
D.达到平衡时,途径I的气体密度为途径Ⅱ密度的1/2
X、Y、Z、R、W是5种短周期元素,原子序数依次增大,它们可组成离子化合物Z2Y和共价化合物RY3、XW4,已知Y、R同主族, Z、R 、W同周期。下列说法不正确的是
| A.原子半径:Z>R>W |
| B.X2W6分子中各原子均满足8电子结构 |
| C.气态氢化物稳定性:HmW>HnR |
| D.Y、Z、R三种元素组成的化合物水溶液一定显碱性w ww.k s5u. co m |
下列化学实验事实解释正确的是
| A.过量的铜屑与稀硝酸作用,反应停止后,再加入1mol/L稀硫酸,铜屑又逐渐溶解,是因为铜可直接与1mol/L稀硫酸反应 |
| B.铁钉放在浓硝酸中浸泡后,再用蒸馏水冲洗,然后放入CuSO4溶液中不反应,说明铁钉表面形成了一层致密稳定的氧化膜 |
| C.相同物质的量浓度乙酸铅溶液导电能力比乙酸钙弱得多,说明乙酸铅属于非电解质 |
| D.浓NH4Cl溶液处理过的舞台幕布不易着火,是因为处理后幕布质量增加,着火点升高 |
在下列各组溶液中,离子一定能大量共存的是
| A.加入KSCN溶液显红色的溶液:K+、NH4+、Cl-、I- |
| B.常温下,pH=1的溶液:Fe3+、Na+、NO3-、SO42- |
| C.滴入酚酞试液显红色的溶液:Mg2+、Al3+、Br-、SO42- |
| D.含0.1mol/LNH4Al(SO4)2·12H2O的溶液:K+、Ca2+、NO3-、OH- |
在下列各组溶液中,离子间一定能大量共存的是
| A. | pH=1的溶液:K +、Cu 2+、Br -、SO 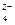 |
| B. | 含有0.1mol/LI -的溶液:NH 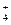 、Fe 3+、SO 、Fe 3+、SO 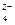 、Cl - 、Cl - |
| C. | 含有0.1mol/LHCO 3 -的溶液:Na +、Al 3+、NO 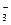 、OH - 、OH - |
| D. | 强酸性溶液:K +、Mg 2+、NO 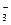 、ClO - 、ClO - |
化学在生产和日常生活中有着重要的应用。下列说法不正确的是
| A.K2FeO4能与水缓慢反应生成Fe(OH)3和O2,故可用作水的消毒剂和净化剂 |
| B.钢铁表面烤蓝生成一层致密的Fe3O4,能起到防腐蚀作用 |
| C.常温下氨能与氯气反应生成氯化氢和氮气,因此可用浓氨水检查氯气管道某处泄漏 |
| D.用氯气与乙烷混合光照获得纯净的1,2-二氯乙烷 |