对于热方程式说法正确的是:
A.中和热ΔH=-57.3 kJ·mol-1,, 则2H+(aq)+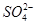 (aq)+Ba2+(aq)+2OH-(aq)===BaSO4(s)+2H2O(l) △H=-114.6 kJ·mol-1 (aq)+Ba2+(aq)+2OH-(aq)===BaSO4(s)+2H2O(l) △H=-114.6 kJ·mol-1 |
| B.将0.5 molN2和1.5 mol H2于密闭容器生成NH3(g),放热19.3 kJ,方程式为: N2(g)+3H2(g)  2NH3(g)△H="—38.6" kJ·mol—1 2NH3(g)△H="—38.6" kJ·mol—1 |
| C.标准状况:H2(g)+F2(g) ==="2HF(g)" △H=-270kJ/mol, |
| D.氨氧化:4NH3(g)+5O2(g) ===4NO(g)+6H2O(g)△H=-1025 kJ/mol |
下列装置或操作能达到实验目的的是()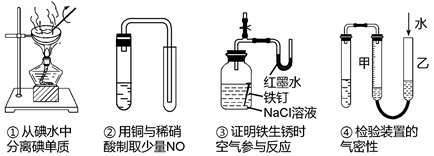
| A.①② | B.③④ | C.②③④ | D.①②③④ |
目前电解法制烧碱通常采用离子交换膜法,阳(阴)离子交换膜不允许阴(阳)
离子通过。则以下叙述错误的是()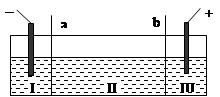
| A.NaOH、H2均在Ⅰ区产生 |
| B.图中a为阴离子交换膜 |
| C.Ⅲ区炭棒上的电极反应式为2Cl--2e →Cl2↑ |
| D.电解时往Ⅲ区的溶液中滴加甲基橙,溶液先变红后褪色 |
室温下,有关①100 mL 0.1 mol/L NaHCO3、②100mL 0.1 mol/L Na2CO3两种溶液的叙述错误的是()
| A.两溶液中水的电离度比较:②>① |
| B.分别加入少量NaOH固体,恢复到原温度,c(CO32-)均增大 |
| C.①溶液中: c(CO32-) < c(H2CO3) |
| D.②溶液中: c(HCO3-) < c(H2CO3) |
NA为阿伏加德罗常数,下列叙述错误的是()
| A.46g NO2和N2O4的混合气体中含有的原子总数为3NA |
| B.12g金刚石中含有的共价键键数为4NA |
| C.0.1 mol NaHCO3晶体中含0.2NA个离子 |
| D.将0.2 mol的硫化钾溶于水配成1升溶液,其阴离子数目肯定多于0.2NA |
下列有关物质的性质或应用的说法中正确的是()
| A.铝合金是一种混合物,它比纯铝的熔点高 |
| B.水晶项链和餐桌上的瓷盘都是硅酸盐制品 |
| C.电解从海水中得到的氯化镁溶液可获得金属镁 |
| D.一定条件下,用秸秆可以制得葡萄糖和酒精 |