一定温度下,将1molA和1molB气体充入2L恒容密闭容器,发生A(g)+ B(g)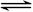 xC(g)+D(s),t1时达到平衡,在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示,正确的是
xC(g)+D(s),t1时达到平衡,在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示,正确的是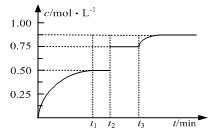
| A.方程式中x=1 | B.t2时刻改变是使用催化剂 |
| C.t3时刻改变是移去少量物质D | D.t1~t3间该反应的平衡常数均为4 |
下列各组物质互为同素异形体的是()
| A.红磷和白磷 | B.磷酸和偏磷酸 |
| C.NO2和N2O4 | D.35Cl和37Cl |
农用化肥和城市生活污水的排放会使地下水含氮量增高,其对人体有害的含氮污染物存在的主要形式是()
A. |
B. |
C. |
D.有机氮 |
下列事实或名词与环境污染无关的是()
| A.温室效应 | B.酸雨 | C.光化学烟雾 | D.潮汐 |
室温时,容量为18 mL的试管里充满NO2气体,然后将它倒置于水中,直到管内水面不再上升为止,再通入6 mL O2,最后试管内还有( )
| A.3 mL O2 |
| B.1.5 mL O2 |
| C.3 mL NO |
| D.1.5 mL NO |
某硝酸盐受热分解生成金属氧化物、二氧化氮和氧气,若生成的二氧化氮和氧气的物质的量之比为8∶1,则金属元素的化合价在反应过程中的变化是( )
| A.升高 | B.降低 |
| C.不变 | D.无法确定 |