下列关于热化学反应的描述中正确的是
| A.HCl和NaOH反应的中和热ΔH=-57.3 kJ•mol-1, 则H2SO4和Ca(OH)2反应的中和热为ΔH=2×(-57.3) kJ•mol-1 |
| B.CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g) =2CO(g)+O2(g)反应的ΔH=+566.0 kJ•mol-1 |
| C.需要加热才能发生的反应一定是吸热反应 |
| D.Ba(OH)2·8H2O与NH4Cl反应的焓变小于0,所以在常温下能自发进行 |
三聚氰胺(结构式如图9所示)是一种重要的化工原料,可用于阻燃剂、水泥减水剂和高分子合成等领域。一些不法分子却往牛奶中加入三聚氰胺,以提高奶制品的含氮量。下列说法正确的是
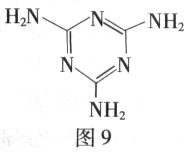

| A. | 三聚氰胺是一种蛋白质  |
B. | 三聚氰胺是高分子化合物  |
C. | 三聚氰胺分子中含有碳碳双键  |
D. | 三聚氰胺的分子式为 |
下列实验能达到实验目的且符合安全要求的是()
 A.
A. B.
B. C.
C. D.
D.
制备氢氧化亚铁 收集氧气 制备并检验氢气的可燃性 浓硫酸稀释
并观察其颜色
环保部门每天通过新闻媒体向社会发布以污染物浓度为标准确定的空气质量信息.这些污染物是
| A.二氧化硫、氮氧化物、一氧化碳、悬浮微粒 |
| B.二氧化硫、氮氧化物、二氧化碳、悬浮微粒 |
| C.稀有气体、氮氧化物、一氧化碳、悬浮微粒 |
| D.稀有气体、氮氢化物、一氧化碳、悬浮微粒 |
将等物质的量的SO2气体和Cl2同时作用于湿润的红色布条.则布条的颜色
| A.变白 |
| B.不变 |
| C.先褪色后又复原 |
| D.变为无色 |
下列说法中不正确的是
| A.硫单质与金属铁的反应生成硫化亚铁,体现了硫单质的氧化性 |
| B.SO2能使酸性KMnO4溶液、氯水退色,说明SO2具有漂白作用 |
| C.H2S既有还原性,又有氧化性 |
| D.医疗上常用BaSO4作X射线透视的“钡餐” |