下图是198 K时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是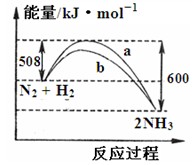
A.该反应的热化学方程式为:N2 + 3H2 2NH3△H =-92 kJ·mol-1 2NH3△H =-92 kJ·mol-1 |
| B.向一密闭容器中加入1 molN2和3 molH2充分反应后,放出92 kJ热量 |
| C.b曲线可能是加入催化剂时的能量变化曲线 |
| D.加入正催化剂可增大正反应速率,降低逆反应速率 |
SiO2是一种化工原料,可以制备一系列物质。下列说法正确的是()
| A.图中所有反应都不属于氧化还原反应 |
| B.硅酸盐的化学性质稳定,常用于制造光导纤维 |
| C.可用盐酸除去石英砂(主要成分为SiO2)中少量的碳酸钙 |
| D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高 |
X、Y、Z、W有如图所示的转化关系,则X、Y可能是()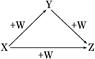
①C、CO;②AlCl3、Al(OH)3;③N2、NO;④S、SO2;⑤NaOH、Na2CO3
A.①②⑤ B.②③⑤ C.③④D.①②④
用如图所示实验装置进行物质性质的探究实验。下列说法不合理的是()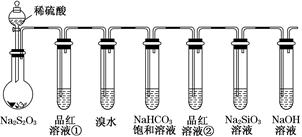
| A.若品红溶液①褪色,则说明产物中含有SO2 |
| B.若溴水褪色,则说明SO2具有还原性 |
| C.若烧瓶中产生黄色浑浊和无色气泡,则说明Na2S2O3只作氧化剂 |
| D.若品红溶液②不褪色、Na2SiO3溶液中出现白色浑浊,则说明亚硫酸比碳酸的酸性强 |
氮、氧、硫、氯是四种重要的非金属元素,下列有关说法中正确的是()
| A.NO在加热条件下才能与空气中的氧气反应 |
| B.氮、硫的最高价氧化物对应水化物的溶液均具有很强的氧化性 |
| C.用石墨作电极电解物质的量浓度相等的硫化钠、氯化钠混合溶液,阳极上析出的物质依次为Cl2、S、O2 |
| D.四种元素的单质中化学性质最稳定的是N2,其次是硫 |
下列推断正确的是()
| A.Na2O、Na2O2组成元素相同,与CO2反应的产物也相同 |
| B.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
| C.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 |
| D.SiO2是酸性氧化物,能与NaOH溶液反应 |