( 10分)自然界的矿物、岩石的成因和变化受到许多条件的影响。地壳内每加深1km,压强增大约25000~30000 kPa。在地壳内SiO2和HF存在以下平衡:SiO2(s) +4HF(g) SiF4(g)+ 2H2O(g) ΔH =" -148.9" kJ/mol
SiF4(g)+ 2H2O(g) ΔH =" -148.9" kJ/mol
(1)在地壳深处容易有 气体逸出,在地壳浅处容易有 沉积。
(2)如果上述反应的平衡常数K值变大,该反应 (选填编号)。
a.一定向正反应方向移动 b.在平衡移动时正反应速率先增大后减小
c.一定向逆反应方向移动 d.在平衡移动时逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时, 。
a.2v正(HF)=v逆(H2O) b.v(H2O)=2v(SiF4)
c.SiO2的质量保持不变 d.反应物不再转化为生成物
(4)若反应的容器容积为2.0L,反应时间8.0 min,容器内气体的密度增大了0.12 g/L,在这段时间内HF的平均反应速率为 。
写出下列盐溶液的水解离子方程式:
(1)Fe(NO3)3 ;
(2)NaF;
(3)K2CO3;;
写电离方程式:(1)H2SO4;
(2)NaHCO3;;
(共15分)
下列物质的相互转化关系中,甲、乙、丙是三种金属单质,甲燃烧时,火焰呈黄色;A、C、D为气体,C在通常情况下呈黄绿色;H为红褐色沉淀物(图中部分反应的条件和生成物未全部标出)。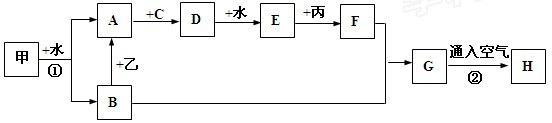
(1)B的俗名:;E的名称:。
(2)①写出反应①的离子方程式:;
②写出B→A的离子方程式:;
③写出反应②的化学方程式:;
此过程中物质的颜色变化情况为:。
(3)①写出反应C +丙反应的化学方程式:;
②写出反应C + F反应的离子方程式:。
③若C+F的产物为I,则检验I中阳离子的试剂是:(化学式),现象为。
某二元酸(化学式用H2A表示)在水中的电离方程式是(第一步电离完全):
H2A="=" H+ +HA- HA-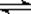 H+ + A2-
H+ + A2-
回答下列问题:
(1)Na2A溶液显____________(填“酸性”、“中性”、“碱性”)
理由是:(用离子方程式表示)__________________________________________。
(2)0.1mol/L的H2A溶液的pH_________1(填“<”“=”“>”)
(3)0.1mol/L的Na2A溶液中,下列微粒浓度关系错误的是_____________。
| A.c(Na+) =2c(A2-) =" 0.2" mol/L |
| B.c(OH-) = c(H+) + c(HA-) |
| C.c(Na+) + c(H+) = c(OH-) + c(HA-) + 2c(A2-) |
| D.c(Na+) =" 2c" (A2-) + 2c (HA-) |
可逆反应:aA(g)+ bB(g) cC(g)+ dD(g);根据图回答:
cC(g)+ dD(g);根据图回答:
(1)压强 P1比P2(填大或小);(2)(a +b)比(c +d)(填大或小);
(3)温度t1℃比t2℃(填高或低);(4)正反应为反应。