(1)2SO2(g)+O2(g)  2SO3(g) 反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= –99kJ/mol。请回答下列问题:
2SO3(g) 反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= –99kJ/mol。请回答下列问题:
①图中A点表示 ; C点表示 ;E的大小对该反应的反应热 ;(填“有”或“无”)影响。
②图中△H= kJ/mol。
(2)25℃、101 kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,则氢气的燃烧热的化学方程式为 。
(3)①C(s) + O2(g) = CO2(g);ΔH = –393.5kJ/mol
②CO(g) + 1/2 O2(g) = CO2(g);ΔH = –283kJ/mol
根据上述信息,写出C转化为CO的热化学方程式为 。
我国某大型电解铜生产企业,其冶炼工艺中铜、硫回收率达到97%、87%。下图表示其冶炼加工的流程:
冶炼中的主要反应:Cu2S + O2 =" 2Cu" + SO2
(1)烟气中的主要废气是________________,从提高资源利用率和减排考虑,其综合利用方式是制___________。
(2)电解法炼铜时,阳极是____________(填“纯铜板”或“粗铜板”);粗铜中含有的金、银以单质的形式在电解槽_______________(填“阳极”或“阴极”的槽底,阴极的电极反应式是_________________________________________。
(3)在精炼铜的过程中,电解质溶液中c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解。
几种物质的溶度积常数(KSP):
| 物质 |
Fe(OH)2 |
Fe(OH)3 |
Zn(OH)2 |
Cu(OH)2 |
| KSP |
8.0×10-16 |
4.0×10-38 |
3.0×10-17 |
2.2×10-20 |
调节电解液的pH是除去杂质离子的常用方法。根据上表中溶度积数据判断,含有等物质的量浓度的Fe2+、Zn2+、Fe3+、Cu2+的溶液,随pH升高最先沉淀下来的离子是______________。
一种方案是先加入过量的H2O2,再调节pH到4左右。加入H2O2后发生反应的离子方程式为___________________________________________________________________________。
铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得。铝土矿的主要成分是Al2O3和SiO2及其它不溶于NaOH溶液的杂质。从铝土矿中提炼Al2O3的流程如下:
回答下列问题:
(1)写出反应1的化学方程式;
(2)滤液Ⅰ中加入CaO生成的沉淀是,反应2的离子方程式为;
(3)电解制铝的化学方程式是,以石墨为电极,阳极产生的混合气体的成分是。
硫醇-烯具有反应过程相对简单、反应过程可控等优点,成为近年来有机合成的研究热点之一,如反应①:
(1)化合物I的分子式为______________,反应①的反应类型为______________。
(2)化合物Ⅱ与Br2加成的产物的结构简式为______________。
(3)化合物Ⅲ的氧化产物化合物Ⅳ能发生银镜反应,则Ⅲ的结构简式为_________。化合物Ⅳ与新制Cu(OH)2反应的化学方程式____________________________。
(4)化合物Ⅲ的一种同分异构体Ⅴ有如下特征:a.含有苯环,且苯环上有两个取代基;b.能与FeCl3溶液发生显色反应;c.核磁共振氢谱显示存在5组峰,峰面积之比为1∶1∶2∶2∶6。化合物Ⅴ的结构简式为____________。
化合物M是一种治疗心脏病药物的中间体。以A为原料的工业合成路线如下图所示。己知:RONa+R′Cl→ROR′+NaCl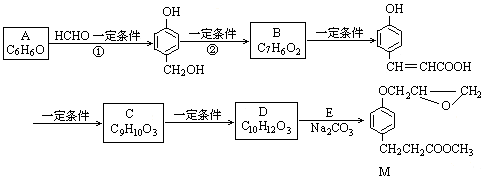
根据题意完成下列填空:
(1)写出反应类型。反应①反应②
(2)写出结构简式。AC
(3)写出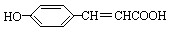 的邻位异构体分子内脱水产物香豆素的结构简式。
的邻位异构体分子内脱水产物香豆素的结构简式。
(4)由C生成D的另一个反应物是,反应条件是。
(5)写出由D生成M 的化学反应方程式。
(6)A也是制备环己醇( )的原料,写出检验A已完全转化为环己醇的方法。
)的原料,写出检验A已完全转化为环己醇的方法。
X、Y、Z、Q、W、R六种短周期元素原子序数依次增大,化合物甲由X、Z、Q三种元素组成,常温下0.1mol/L甲溶液的pH=13,工业上常用电解饱和QR溶液生成甲;化合物乙由X、R两种元素组成。请回答以下问题:
(1)Q的原子结构示意图为。
(2)Y元素的单质能发生如图所示的转化,则Y元素为(用元素符号表示)。在甲溶液中通入足量YZ2气体,所得溶液呈碱性,原因是(用离子方程式和必要的文字说明)。
(3)W的单质既能与甲溶液反应,又能与乙溶液反应。
①常温下,将W的单质和甲溶液混合,发生反应的离子方程式为:
②Q、W两种元素金属性的强弱为QW(填“>”、“<”) ;下列表述中证明这一事实的是。
a.Q的单质的熔点比W单质低
b.Q的最高价氧化物的水化物的碱性比W的最高价氧化物的水化物的碱性强
c. W的原子序数大