煤化工中常需研究不同温度下的平衡常数、投料比及产率等问题。已知:
CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数随温度的变化如下表:
CO2(g)+H2(g)的平衡常数随温度的变化如下表:
| 温度/℃ |
400 |
500 |
830 |
1000 |
| 平衡常数K |
10 |
9 |
1 |
0.6 |
试回答下列问题:(1)上述反应的正反应是 反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,正反应速率
(填“增大”、“减小”或“不变”),容器内混合气体的压强 (填“增大”、“减小”或“不变”)。
(3)830℃,在恒容反应器中发生如表中的反应,按表中的物质的量投入反应混合物,其中向正反应方向进行的有 (选填A、B、C、D)。
(4)830℃时,在2L的密闭容器中加入4molCO(g)和6molH2O(g)达到平衡时,CO的转化率是 。
(1)写出表示含有8个质子、10个中子、10个电子的离子的符号 。(写成ZAXn-的形式)
(2)周期表中位于第8纵行的铁元素属于第 族。
(3)周期表中最活泼的非金属元素位于第 纵行 族。
【化学—物质结构与性质】
电石(CaC2)发生如下反应合成尿素[CO(NH2)2],可进一步合成三聚氰胺。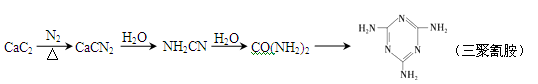
(1)CO(NH2)2分子中含有σ键的个数为______。CaCN2中阴离子为CN22-,与CN22-离子互为等电子体的分子的化学式为_______,可推知CN22-的空间构型为_________。
(2)三聚氰胺在动物体内可转化为三聚氰酸( ),三聚氰酸分子中N原子采取______杂化。三聚氰胺与三聚氰酸的分子相互之间通过________结合,在肾脏内易形成结石。
),三聚氰酸分子中N原子采取______杂化。三聚氰胺与三聚氰酸的分子相互之间通过________结合,在肾脏内易形成结石。
(3)下图是电石的晶胞示意图,则一个晶胞中含有___个Ca2+离子,研究表明,C22-的存在使晶胞呈长方体,该晶胞中一个Ca2+周围距离相等且最近的C22-有___个。
【化学—化学与技术】
铝生产产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成。
(1)工业上采用电解氧化铝和冰晶石(Na3AlF6)熔融体的方法冶炼得到金属铝:2Al2O3 4Al+3O2↑。
4Al+3O2↑。
加入冰晶石的作用为_______________________。
(2)上述工艺所得铝材中往往含有少量Fe和Si等杂质,可用电解方法进一步提纯,该电解池中阳极的电极反应式为________,下列可作阴极材料的是______。
a.铝材b.石墨c.铅板d.纯铝
(3)阳极氧化能使金属表面生成致密的氧化膜。以稀硫酸为电解液,铝阳极发生的电极反应式_______________________。在铝阳极氧化过程中,需要不断地调整电压,理由是_________________。
(4)下列说法正确的是__________________。
a.阳极氧化是应用原电池原理进行金属材料表面处理的技术
b.铝的阳极氧化可增强铝表面的绝缘性能
c.铝的阳极氧化可提高金属铝及其合金的耐腐蚀性,但耐磨性下降
d.铝的阳极氧化膜富多孔性,具有很强的吸附性能,能吸附染料而呈各种颜色
工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量FeO、CuO等氧化物杂质)制取金属锌的流程如图所示。
(1)提高酸浸效率的措施为_________________________________(任答一条即可);酸浸时H+与难溶固体ZnFe2O4反应的离子方程式为___________________。
(2)净化Ⅰ中H2O2参与反应的离子方程式为____________________________;X可选择的试剂为______(写化学式)。净化Ⅱ中Y为_____________(写化学式)。
(3)电解法制备锌的装置如图甲所示:
则电解槽中盛有的电解质溶液为______(填字母)。
a.ZnCl2溶液b.Zn(NO3)2溶液c.ZnSO4溶液
根据图甲中的数据,可求得电解过程中电流的有效利用率为_________。
(4)使用含有[Zn(OH)4]2-的强碱性电镀液进行镀锌防腐蚀,可得到细致的光滑镀层,电镀时阴极电极反应式_____________________。以锌为负极,采用牺牲阳极法防止铁闸的腐蚀,图乙中锌块的固定位置最好应在_____处(填字母)。
研究氮的固定具有重要意义。
(1)雷雨天气中发生自然固氮后,氮元素转化为________而存在于土壤中。处于研究阶段的化学固定
新方法是N2在催化剂表面与水发生如下反应:
2N2(g)+6H2O(l)=4NH3(g)+3O2(g) △H K①
已知:N2(g)+3H2(g)=2NH3(g)△H1=-92.4kJ·mol-1 K1②
2H2(g) +O2(g) =2H2O(l)△H2=-571.6kJ·mol-1 K2③
则△H =________;K=___________(用K1和 K2表示)。
(2)在四个容积为2L的密闭容器中,分别充入1mol N2、3mol H2O,在催化剂条件下进行反应①3h,实验数据见下表:
| 序号 |
第一组 |
第二组 |
第三组 |
第四组 |
| t/℃ |
30 |
40 |
50 |
80 |
| NH3生成量/(10﹣6mol) |
4.8 |
5.9 |
6.0 |
2.0 |
下列能说明反应①达到平衡状态的是_____(填字母)。
a.NH3和O2的物质的量之比为4∶3
b.反应混合物中各组份的质量分数不变
c.单位时间内每消耗1molN2的同时生成2molNH3
d.容器内气体密度不变
若第三组反应3h后已达平衡,第三组N2的转化率为___________;第四组反应中以NH3表示的反应速率是__________________,与前三组相比,NH3生成量最小的原因可能是_________________。
(3)美国化学家发明一种新型催化剂可以在常温下合成氨,将其附着在电池的正负极上实现氮的电化学固定,其装置示意图如下: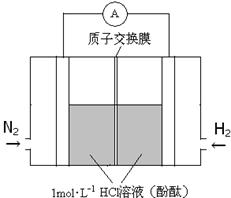
则开始阶段正极反应式为_____________;忽略电解过程中溶液体积变化,当电池中阴极区溶液pH = 7时,溶液中NH3·H2O的浓度为___________( Kb=2×10-5mol·L-1);当电池中阴极区呈红色时,溶液中离子浓度由大到小的顺序为_________________。