经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。下列判断正确的是
| A.AlCl3为离子化合物 | B.SiCl4为共价化合物 |
| C.P 与Cl可形成离子键 | D.K与Mg 形成共价键 |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A.与Al反应放出H2的溶液:Mg2+、Ca2+、HCO3-、NO3- |
| B.10 mol·L-1的浓氨水:Al3+、NH4+、NO3-、I— |
| C.0.1 mol·L-1KMnO4溶液:Na+、Fe2+、SO42-、Cl— |
| D.c(H+)/c(OH—)=1×10—12的溶液:K+、Na+、AlO2—、CO32— |
下列有关有机物性质的说法正确的是( )
| A.蛋白质可以与酸、碱或重金属盐反应 |
| B.芳香烃都不能使酸性KMnO4溶液褪色 |
| C.CH3CH2OH与氢溴酸不能反应 |
| D.石油的分馏可获得乙烯、丙烯等不饱和烃 |
下列措施不合理的是( )
| A.用SO2漂白纸浆和草帽辫 |
| B.用硫酸清洗锅炉中的水垢 |
| C.高温下用焦炭还原SiO2制取粗硅 |
| D.用Na2S作沉淀剂,除去废水中的Cu2+和Hg2+ |
当两种有机物总质量一定时,以任意比例混合后,充分燃烧,所得的CO2和H2O的物质的量总是相等的是()
| A.乙醇、乙醚 | B.乙烯、丁烯 | C.苯、苯酚 | D.甲烷、甲醇 |
膳食纤维具有的突出保健功能,近年来受到人们的普遍关注,被世界卫生组织称为人体的“第七营养素”。木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构如下图所示。下列说法正确的是()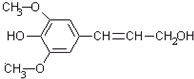
| A.芥子醇的分子式是C11H12O4,属于芳香族化合物 |
| B.芥子醇分子中所有碳原子可能在同一平面上 |
| C.芥子醇分子中含9种不同化学环境的H原子 |
| D.1mol芥子醇能与足量溴水反应消耗1molBr2 |