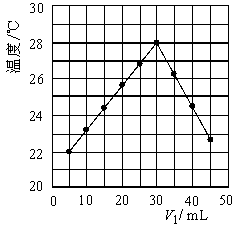
将V1 mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。下列叙述正确的是
| A.做该实验时环境温度为22 ℃ |
| B.该实验表明化学能可以转化为热能 |
| C.NaOH溶液的浓度约是1.00 mol/L |
| D.该实验表明有水生成的反应都是放热反应 |
一定量的乙醇在氧气不足的情况下燃烧,得到CO、CO2、和水的总质量为27.6 g,若其中水的质量是10.8 g ,则CO2的质量为
| A.1.4 g | B.15.4 g | C.4.4 g | D.12.4 g |
以下物质既能够使溴水褪色,又能够与钠反应放出氢气,但不能使pH试纸变色的是
| A.CH2=CH-COOH | B.CH2=CH-COOCH3 |
| C.CH3CH2OH | D.CH2=CH-CH2OH |
乙烯和乙醇的混合气体V L,完全燃烧生成CO2和H2O,消耗相同状态下的O2 3V L,则混合气体中乙烯和乙醇的体积比为
| A.1∶1 | B.2∶1 | C.1∶2 | D.任意比 |
将1-氯丙烷跟NaOH的醇溶液共热,生成的产物再跟溴水反应,得到一种有机物,它的同分异构体有(除它之外)
| A.2种 | B.3种 | C.4种 | D.5种 |
有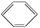 、CH3CH2OH、CH3CH2Br、NH4Cl溶液四种无色液体,只用一种试剂就能把它们鉴别开,这种试剂是
、CH3CH2OH、CH3CH2Br、NH4Cl溶液四种无色液体,只用一种试剂就能把它们鉴别开,这种试剂是
| A.溴水 | B.NaOH溶液 | C.Na2SO4溶液 | D.Br2的CCl4溶液 |