下列离子方程式中书写正确的是( )
| A.铁和稀硫酸反应:2Fe+6H+===2Fe3++3H2↑ |
| B.碳酸钙和稀盐酸反应:CaCO3+2H+===Ca2++CO2↑+H2O |
| C.铜和硝酸银溶液反应:Cu+Ag+===Cu2++Ag |
| D.硫酸镁溶液与氢氧化钡溶液反应:Mg2++2OH-===Mg(OH)2↓ |
下列实验现象所对应的离子方程式不正确的是( )
| 实验 |
现象 |
离子方程式 |
|
| A |
 H2SO4 KI淀粉溶液 |
在空气中放置一段时间后溶液呈蓝色 |
4H++4I-+O2 2I2+2H2O 2I2+2H2O |
| B |
 稀盐酸 稀碳酸钠溶液 |
开始时无气泡,后来有气泡 |
C +H+ +H+ HC HC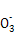 HC 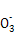 +H+ +H+ CO2↑+H2O CO2↑+H2O |
| C |
 NaOH溶液 氯水 |
溶液由淡黄绿色变为无色 |
Cl2+2OH- Cl-+ClO-+H2O Cl-+ClO-+H2O |
| D |
 H2SO4加有 酚酞的Ba(OH)2 溶液 |
有白色沉淀生成,溶液由红色变为无色 |
Ba2++OH-+H++S  BaSO4↓+H2O BaSO4↓+H2O |
常温时,下列各组离子在指定溶液中一定能大量共存的是( )
A.pH=0的溶液中:Na+、Fe2+、N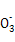 、ClO- 、ClO- |
B.c(Fe3+)="0.1" mol/L的溶液中:K+、Ba2+、S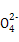 、SCN- 、SCN- |
C.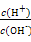 =1012的溶液中:N =1012的溶液中:N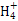 、Al3+、S 、Al3+、S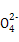 、Cl- 、Cl- |
D.由水电离的c(H+)=1×10-14 mol/L的溶液中:Ca2+、K+、Cl-、HS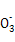 |
下列离子方程式书写正确的是( )
A.Na2O2与H2O反应:2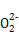 +2H2O +2H2O 4OH-+O2↑ 4OH-+O2↑ |
B.FeCl2溶液与稀硝酸反应:Fe2++N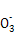 +4H+ +4H+ Fe3++NO↑+2H2O Fe3++NO↑+2H2O |
C.CaCO3与醋酸溶液反应:CaCO3+2H+ Ca2++CO2↑+H2O Ca2++CO2↑+H2O |
D.KAl(SO4)2溶液与氨水反应:Al3++3NH3·H2O Al(OH)3↓+3N Al(OH)3↓+3N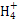 |
室温时,下列各组离子在指定溶液中可以大量共存的是( )
A.由水电离出的c(H+)=10-12 mol/L的溶液中:Na+、Ba2+、HC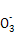 、C1- 、C1- |
B.无色透明溶液中:K+、Cu2+、S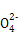 、Na+ 、Na+ |
C.含有大量Al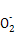 的溶液中:Na+、OH-、Cl-、C 的溶液中:Na+、OH-、Cl-、C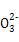 |
D.能使pH试纸显红色的溶液中:Na+、ClO-、Fe2+、S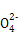 |
下列离子方程式均正确的是( )
A.用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+ Cu2++2Fe2+ Cu2++2Fe2+ |
B.铜与浓硝酸反应:Cu+N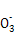 +2H+ +2H+ Cu2++NO2↑+H2O Cu2++NO2↑+H2O |
C.向NaAlO2溶液中通入过量CO2:2Al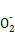 +CO2+3H2O +CO2+3H2O 2Al(OH)3↓+C 2Al(OH)3↓+C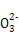 |
D.NaHCO3的水解:HC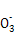 +H2O +H2O H3O++C H3O++C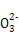 |