某烃的结构简式为.分子中饱和碳原子数为a,可能在同一直线上的碳原子数为b,一定在同一平面上的碳原子数为c,则a、b、c分别为 ( )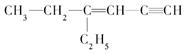
| A.4、3、7 | B.4、3、6 | C.2、5、4 | D.4、6、4 |
可逆反应H2(g) + I2(g)  2HI(g)达到平衡的标志是
2HI(g)达到平衡的标志是
| A.H2、I2、HI的浓度相等 | B.H2、I2、HI的浓度保持不变 |
| C.混合气体的密度保持不变 | D.混合气体的质量不再改变 |
在乙酸、乙醇和浓硫酸混合物中,加入H218O,过一段时间后,18O存在于()
| A.只存在于乙酸分子中 | B.存在于乙酸和乙酸乙酯中分子中 |
| C.只存在于乙醇分子中 | D.存在于水和乙酸分子中 |
化学与生产、生活、社会密切相关,下列有关说法不正确的是( )
| A.多用电子邮件、MSN、QQ等即时通讯工具,少用传真打印机属于“低碳生活”方式 |
| B.我国神七宇航员所穿航天服主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型无机非金属材料 |
| C.食品保鲜膜、一次性食品袋的主要成分是聚氯乙烯 |
| D.日本福岛核电站爆炸时释放的2种放射性同位素131I与137Cs的中子数不等 |
我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流。电池总反应为:4Al+3O2+6H2O=4Al(OH)3,下列说法不正确的是( )
| A.正极反应为:O2+2H2O+4e-=4OH- |
| B.电池工作时,电流由铝电极沿导线流向铂电极 |
| C.以网状的铂为正极,可增大与氧气的接触面积 |
| D.该电池通常只需更换铝板就可继续使用 |
有两种短周期元素X和Y,可组成化合物XY3,当Y的原子序数为m时,X的原子序数为:①m-4;②m+4;③m+8;④m-2;⑤m+6。其中正确的组合是( )
| A.①②④ | B.①②⑤ | C.①②③⑤ | D.①②③④⑤ |