对室温下pH、体积均相同的醋酸和盐酸溶液采取下列措施,有关叙述不正确的是
| A.使温度都升高20℃后,两溶液的pH均不变 |
| B.加水稀释10倍后,两溶液的pH均增大 |
| C.加少量氢氧化钠钠晶体后,两溶液的pH均增大 |
| D.加足量的锌充分反应后,两溶液中产生的氢气醋酸比盐酸多 |
下列不能说明氯的非金属性比硫强的事实是()
①HCl比H2S稳定②HClO氧化性比H2SO4强③HClO4酸性比H2SO4强④Cl2能与H2S反应生成S⑤在与钠反应时,S原子得到的电子数更多⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS⑦HCl酸性比H2S强
| A.②⑤⑦ | B.①②⑦ | C.②④ | D.①③⑤ |
已知X+、Y2+、Z-、W2-四种离子均具有相同的电子层结构。下列关于X、Y、Z、W四种元素的描述,不正确的是( )
| A.原子半径:X>Y>Z>W | B.原子序数:Y>X>Z>W |
| C.原子最外层电子数:Y>X>Z>W | D.金属性:X>Y,还原性:W2->Z- |
灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:
①Sn (s、白)+2HCl (aq)=SnCl2 (aq)+H2 (g);DH1
②Sn (s、灰)+2HCl (aq)=SnCl2 (aq)+H2 (g);DH2
③Sn (s、灰) 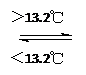 Sn (s、白);DH3=+2.1 kJ/mol
Sn (s、白);DH3=+2.1 kJ/mol
下列说法正确的是( )
| A.DH1>DH2 |
| B.锡在常温下以灰锡状态存在 |
| C.灰锡转化为白锡的反应是放热反应 |
| D.锡制器皿长期处于低于13.2 ℃的环境中,会自行毁坏 |
关于铜-锌-稀硫酸构成的原电池的有关叙述正确的是()
| A.锌为负极,锌发生还原反应Zn - 2e- =Zn2+ |
| B.电流方向经外电路由锌到铜 |
| C.工作时SO42-离子向正极移动 |
| D.外电路电子流入的一极为正极,电子流出的一极为负极 |
在20世纪90年代末期,科学家发现并证明碳有新的单质形态C60存在。
后来人们又相继得到了C70、C76、C84、C90、C94等另外一些球碳分子。21世纪初,科学家又发现了管状碳分子和洋葱状碳分子,大大丰富了碳元素单质的家族。下列有关碳元素单质的说法错误的是()
| A.金刚石和石墨的熔点肯定要比C60高 |
| B.熔点比较:C60<C70<C90 |
| C.球碳分子、管状碳分子、洋葱状碳分子都是分子晶体,都是碳的同素异形体 |
| D.金刚石、石墨晶体属原子晶体;C60、C70、管状碳分子和洋葱状碳分子均属分子晶体。两类不是同素异形体 |