2SO2(g)+O2(g) 2SO3(g);ΔH=-196.6kJ/mol。在一定温度下,向一个容积不变的容器中,通入3mol SO2和2mol O2及固体催化剂,使之反应。平衡时容器内气体压强为起始时的90%。此时
2SO3(g);ΔH=-196.6kJ/mol。在一定温度下,向一个容积不变的容器中,通入3mol SO2和2mol O2及固体催化剂,使之反应。平衡时容器内气体压强为起始时的90%。此时
(1)加入3mol SO2和2mol O2发生反应,达到平衡时,放出的热量为 。
(2)保持同一反应温度,在相同的容器中,将起始物质的量改为amol SO2、bmol O2、cmol SO3(g)及固体催化剂,欲使起始时反应表现为向正反应方向进行,且平衡时SO3的体积分数为2/9,a的取值范围是 。
(3)保持同一反应温度,在相同的容器中,将起始物质的量改为3mol SO2、6mol O2、3mol SO3(g)及固体催化剂,则平衡 移动。(填“正向、不、逆向或无法确定是否)
一定温度下,向装有固体催化剂且容积不变的密闭容器中通入1 mol N2和4 mol H2,使之发生如下反应:
N2(g)+3H2(g)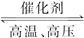 2NH3(g);ΔH=-92.4 kJ·mol-1。
2NH3(g);ΔH=-92.4 kJ·mol-1。
平衡时容器内气体压强为起始时的80%。
(1)通入1 mol N2和4 mol H2,达到平衡时,放出的热量为__________。
(2)保持同一反应温度,在相同的容器中,将起始物质的量改为a mol N2、b mol H2、c mol NH3。
①达到相同的平衡时,(1)与(2)放出的热量值__________ (填序号)。
| A.一定相等 | B.前者一定小 |
| C.前者大于或等于后者 | D.不能确定 |
②a、b、c必须满足的关系是(一个用a、c表示,另一个用b、c表示)___________,___________。
③欲使起始时反应表现为向正反应方向进行,a的取值范围是__________。
t ℃时,将3 mol A和2 mol B气体通入体积为2 L的密闭容器中(容积不变),发生反应:3A(g)+B(g)x C(g),2 min时反应达到平衡状态(温度不变),剩余1.8 mol B,并测得C的浓度为0.4 mol·L-1。请填写下列空白:
C(g),2 min时反应达到平衡状态(温度不变),剩余1.8 mol B,并测得C的浓度为0.4 mol·L-1。请填写下列空白:
(1)x=_________。
(2)用A表示该反应的速率为_________mol·L-1·min-1。
(3)若继续向平衡混合物的容器中通入少量氦气(氦气和A、B、C都不反应)后,下列说法中正确的是_________(填写下列选项字母序号)。
A.化学平衡向正反应方向移动
B.化学平衡向逆反应方向移动
C.化学平衡不会发生移动
D.正、逆反应的化学反应速率将发生同等程度的改变
(4)在t ℃时,若向平衡混合物的容器中再充入a mol C,欲使达到新的平衡时,各物质的物质的量分数与原平衡相同,则至少应再充入B_________mol(用含a的式子表示);达新平衡时,A的物质的量为n(A)=_________(用含a的式子表示)。
温室下取0.2mol/L的盐酸与0.2mol/LMOH等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答下列问题
(1)混合溶液中由水电离出的c(H+)_______0.2mol/L盐酸中水电离出的c(H+)(填“<”、“>”、“=”)。
(2)求出混合溶液中下列算式的精确计算结果(填具体数字,忽略混合后溶液体积的变化),c(Cl—)-c(M+)=_____________mol/L,c(H+)-c(MOH)="_______________" mol/L
(3)室温下如果取0.2mol/LMOH溶液与0.1mol/L盐酸等体积混合,测得混合溶液的pH<7,则说明MOH的电离程度________MCl的水解程度(填“<”、“>”、“=”),溶液中各离子浓度由大到小的顺序为_____________________________
(1)石灰石样品中SiO2的质量分数。
(2)中和多余盐酸所需1mol/L NaOH溶液的体积。
甲、乙两位学生用加热氯酸钾的方法制取氧气。甲取了一定质量的氯酸钾和0.10 g二氧化锰,经混合后装入试管中加热,待收集到所需氧气时停止加热。试管冷却后,乙称得甲留下的反应混合物的质量为4.04 g,将它继续加热,直到氯酸钾全部分解,得到氧气672 mL(标准状况)。求甲实验时氯酸钾分解的百分率。