量取一定体积的液体应用_________,选择的量筒规格与所量液体体积越接近越好。倾倒的液体接近刻度时,应用_________滴加。量液时,量筒必须_________,视线要与量筒内液体_________保持水平再读出读数。仰视时会造成读数偏低,取液偏多;俯视时会造成读数偏大,取液偏少。胶头滴管的使用方法:取液后的滴管,应保持_________在上,不要平放或倒置,防止液体倒流,玷污_________或腐蚀 _________;滴加时把滴管放在容器口上方滴加。用过的滴管要立刻用_________干净(滴瓶上的滴管不要用水冲洗),再放入洁净的小试管中。
化学与人类生活息息相关.请用所学的化学知识回答下列问题.
(1)使用新能源汽车可节约化石燃料(煤、石油和天然气).写出天然气主要成分甲烷(CH4)燃烧的化学方程式 .
(2)化肥对提高农作物产量具有重要作用.尿素[CO(NH2)2]属于 肥(填“氮”、“磷”、“钾”).
(3)氮化镓(GaN)是“蓝色发光二极管”研发技术中的重要材料.
①镓元素(Ga)的原子结构示意图为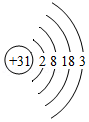 ,在元素周期表中镓元素位于第 周期,镓原子失去电子形成离子的符号可表示为 .
,在元素周期表中镓元素位于第 周期,镓原子失去电子形成离子的符号可表示为 .
②下列原子结构示意图所对应的元素与镓元素的化学性质相似的是 (填字母序号).
A.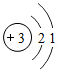 B.
B.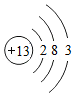 C.
C.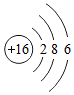 D.
D.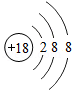
"一带一路"带动了新疆的经济发展,提高了人们的生活质量.
(1)南疆地区是我国重要棉花产地,区别纯棉和涤纶的方法是 .
(2)新疆地方美食"拌面",面中提供的营养素主要是 .
(3)新疆是著名的"瓜果之乡",瓜果可为人体提供大量的维生素C,维生素C可有效预防 病.
建立"宏观﹣微观﹣符号"之间的联系是化学学科的重要特点.
(1)用化学符号和数字表示下列微粒.
2个氢原子 ;2个二氧化硫分子 ;2个硝酸根离子 .
(2)"水循环"和"碳循环"是自然界中存在的两大重要循环.
①从微观的角度看:水分子是由 构成.
②从宏观的角度看:二氧化碳是由 组成.
元素周期表是学习和研究化学的重要工具,请分析图中的信息回答有关问题。
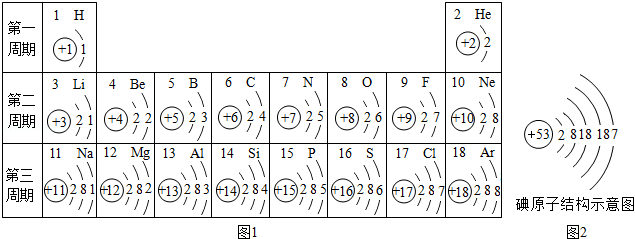
(1)3号元素在化学反应中易失去 个电子。
(2)17号元素形成的离子符号是 。
(3)写出14号与9号元素组成化合物的化学式 。
(4)适当补充碘元素能预防甲状腺疾病,请根据图2推断碘元素在周期表中位于第 周期。
中国高铁制造处于世界先进水平.2014年12月,乌鲁木齐﹣兰州高铁正式通车.
(1)古丽同学乘高铁外出学习,她准备了在高铁上吃的食物有:油饼、风干肉、矿泉水.从营养合理搭配的角度考虑,还缺少的营养素有 ,你认为还应补充 (填食物名称).
(2)高铁建设需要大量的材料,其中主要用到的有:A.金属材料、B.无机非金属材料、C.合成材料、D.复合材料.用对应字母填空.
①钒钢用于制造高铁的铁轨,它属于 .
②高铁座椅上常用到耐磨、耐腐蚀的涤纶等,涤纶属于 .
(3)高铁列车装有烟雾感应器,高速运行时是全封闭的.列车运行过程中在车厢内吸烟的危害是 .