某温度下,H2(g)+CO2(g)  H2O(g)+CO(g)的平衡常数K=9/4.该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示.
H2O(g)+CO(g)的平衡常数K=9/4.该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示.
| 起始浓度 |
甲 |
乙 |
丙 |
| c(H2)(mol/L) |
0.010 |
0.020 |
0.020 |
| c(CO2)(mol/L) |
0.010 |
0.010 |
0.020 |
下列判断不正确的是( )
A.平衡时,乙中CO2的转化率大于60%
B.平衡时,甲中和丙中CO2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol/L
D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
如图所示,隔板K1固定不动,活塞K2可自由移动。T℃时,M、N两个容器中均发生反应N2(g)+3H2(g)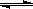 2NH3(g),向容器M、N中各充入l mol N2和3 mol H2,初始M、N的容积和温度相同,并保持温度不变。下列有关说法中不正确的是
2NH3(g),向容器M、N中各充入l mol N2和3 mol H2,初始M、N的容积和温度相同,并保持温度不变。下列有关说法中不正确的是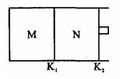
| A.反应达到平衡时N2的转化率:M>N |
| B.H2的体积分数:M>N |
C.容器N中达到平衡,测得容器中含有1.2mol NH3,此时N的容积为VL,则该反应在此条件下的平衡常数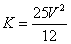 |
| D.该反应在T℃时的平衡常数K:M=N |
在一密闭容器中加入A、B、C三种气体,保持一定温度,在t1~t4时刻测得各物质的浓度如下表。据此判断下列结论正确的是
| 测定时刻/s |
t1 |
t2 |
t3 |
t4 |
| c(A)/(mol·L-1) |
6 |
3 |
2 |
2 |
| c(B)/(mol·L-1) |
5 |
3.5 |
3 |
3 |
| c(C)/(mol·L-1) |
1 |
2.5 |
3 |
3 |
A.在t3时刻反应已经停止
B.A的转化率比B的转化率低
C.在容器中发生的反应为:2A+B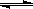 2C
2C
D.在t2~t3内A的平均反应速率为: [1/(t3-t2)]mol·L-1·s-1
反应3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g)在一可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
| A.增加Fe的物质的量 |
| B.将容器的体积缩小一半 |
| C.保持体积不变,充入H2使体系压强增大 |
| D.压强不变,充入Ne使容器的体积增大 |
化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如右图所示,计算反应4~8 min间的平均反应速率和推测反应16 min反应物的浓度,结果应是
| A.2.5μmol·L-1·min-1和2.0μmol·L-1 |
| B.2.5μmol·L-1·min-1和2.5μmol·L-1 |
| C.3.0μmol·L-1·min-1和3.0μmol·L-1 |
| D.5.0μmol·L-1·min-1和3.0μmol·L-1 |
下列反应的热效应与其它三项不相同的是
| A.铝粉与氧化铁的反应 | B.氯化铵与Ba(OH)2•8H2O反应 |
| C.锌片与稀硫酸反应 | D.钠与冷水反应 |