以下说法中正确的是( ).
| A.绝缘体有电阻,导体没有电阻 |
| B.通过导体的电流越大,导体的电阻就一定越大 |
| C.导体两端电压为零时,电流为零,但电阻不为零 |
| D.只有导体才能用作电工材料 |
如图所示,用电压表测灯泡L两端的电压,如干电池的电压为1.5 V,则两图中电压表V1、V2的读数分别是
| A.V1为1.5 V,V2为1.5 V |
| B.V1为1.5 V,V2为零 |
| C.V1为零,V2为1.5 V |
| D.V1V2都是零 |
在两个灯泡串联的电路中,用三只电压表分别测各部分的电压,如图示电路。已知V1、V2、V3三个电压表测出的值分别是U1、U2、U3,则它们的大小关系正确的是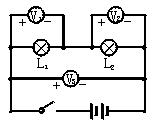
| A.U1=U2 |
| B.U1=U2=U3 |
| C.U1+U2=U3 |
| D.U1+U2>U3 |
如图示电路,闭合开关S后,两盏灯都不发光,电流表指针看不出偏转,电压表示数接近电源电压。这电路的故障可能是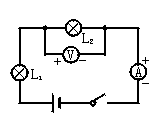
| A.L1发生短路 |
| B.L2发生断路 |
| C.电流表是坏的 |
| D.电灯L1、L2的灯丝都是断的 |
如图所示,箭头表示接好电路时电流的方向,甲、乙、丙三处分别接有电源,电灯和电铃,根据电流的方向可以判断出电源在()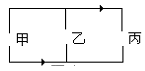
| A.甲处 |
| B.乙处 |
| C.丙处 |
| D.任何一处均可 |