NaHSO4在水溶液中能够电离出H+、Na+和SO42-。下列分类中错误的是
| A.NaHSO4是盐 | B.NaHSO4是酸 |
| C.NaHSO4是钠盐 | D.NaHSO4是酸式盐 |
通过下列方法,不可能将分子式为C2H6O的有机物的同分异构体,区别开来的是
| A.红外光谱 | B.核磁共振氢谱 | C.燃烧法 | D.与钠反应 |
下列化合物的分子中,所有原子都处于同一平面的是
| A.新戊烷 | B.乙醛 | C.三硝基甲苯 | D.四氯乙烯 |
下列命名正确的是
| A.CH3OCH3 :二甲醚 |
B.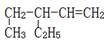 :3-乙基-4-戊烯 :3-乙基-4-戊烯 |
C.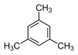 :三甲苯 :三甲苯 |
D.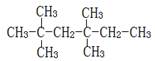 :3,3,5,5-四甲基己烷 :3,3,5,5-四甲基己烷 |
关于分子式为“C4H8”的物质叙述正确的是
| A.与乙烯互为同系物 |
| B.其具有6种同分异构体 |
| C.其一氯代物一共有12种 |
| D.该物质的系统命名的名称为“1-丁烯” |
下列叙述不正确的是
| A.研究有机物的组成、结构、性质、制备方法与应用的科学叫有机化学 |
| B.有机物的反应与无机反应相比具有反应缓慢、产物复杂、常在水溶液中进行等特点 |
| C.人们常利用有机物的性质,合成具有特定性质而自然界并不存在的有机物,满足人类的需要 |
| D.高分子化合物与低分子有机物不仅在相对分子质量和结构上有差异,而且在物理性质、化学性质上也有较大差别 |