下列有关元素的叙述正确的是()
| A.白磷、红磷都是磷元素的单质,它们之间的转化属于物理变化 |
B.地壳中元素含量最高的非金属是 硅、含量最高的金属是铝 硅、含量最高的金属是铝 |
C.原子最外层只有一个 电子的都是金属元素 电子的都是金属元素 |
D.元素周期表中,第三纵行元素种类最 多;第十四纵行元素形成的化合物种类最多 多;第十四纵行元素形成的化合物种类最多 |
地壳中铀的平均含量约为百万分之2.5,在铀元素中,用作核燃料的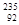 U只占0.724%。铀浓缩是指提高铀元素中
U只占0.724%。铀浓缩是指提高铀元素中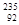 U的含量,一直为国际社会关注。下列说法正确的是()
U的含量,一直为国际社会关注。下列说法正确的是()
A.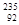 U与
U与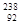 U互为同位素
U互为同位素
B.可利用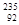 U与
U与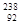 U化学性质的不同将二者分离
U化学性质的不同将二者分离
C .利用化学反应把
.利用化学反应把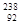 U转化为
U转化为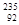 U,提高
U,提高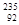 U在铀元素中的含量
U在铀元素中的含量
D.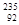 U与
U与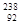 U互为同素异形体
U互为同素异形体
下列离子方程式正确的是()
| A.FeCl3溶液中滴加过量Na2S溶液:2Fe3++S2—═2Fe2++S↓ |
| B.将Na2O2固体投入H218O中:2Na2O2+2H218O=4Na++4OH-+18O2↑ |
| C.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液,恰好使SO42—完全沉淀: NH4++Al3++2SO42—+2Ba2++4OH—= Al(OH)3↓+NH3·H2O+2BaSO4↓ |
| D.少量CO2通入苯酚钠溶液中:2C6H5O—+CO2+H2O = 2C6H5OH+CO32— |
由一种阳离子与两种酸根离子组成的盐称为混盐。混盐CaOCl2 在酸性条件下可以产生氯气,下列关于混盐CaOCl2的有关判断不正确的是 ( )
在酸性条件下可以产生氯气,下列关于混盐CaOCl2的有关判断不正确的是 ( )
| A.该混盐具有较强的氧化性 |
| B.该混盐中氯元素的化合价为+1和-1价 |
| C.该混盐与盐酸反应产生1mol Cl2时转移1mol电子 |
| D.该混盐的水溶液显酸性 |
下列物质反应后一定有+3价铁生成的是()
①过量的Fe与Cl2反应;
②Fe与过量稀H2SO4反应后,再向其中加KNO3;
③Fe(NO3)2溶液中加少量盐酸;
④Fe和Fe2O3的混合物溶于盐酸中。
| A.只有①② | B.只有②③ | C.只有①②③ | D.全部 |