“辛烷值”用来表示汽油的质量,汽油中异辛烷的爆震程度最小,将其辛烷值标定为100,如图是异辛烷的球棍模型,则异辛烷的系统命名为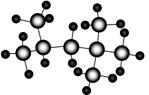
| A.1,1,3,3-四甲基丁烷 | B.2,3,4-三甲基戊烷 |
| C.2,4,4-三甲基戊烷 | D.2,2,4-三甲基戊烷 |
0.6 mol/L的Fe2(SO4)3 和1.2 mol/L的CuSO4 的混合溶液200 mL,加入一定量铁粉充分反应后,测得溶液中Fe2+ 与Cu2+ 物质的量之比为2∶1,则加入铁粉的物质的量为
| A.0.16mol | B.0.22mol | C.0.30mol | D.0.48mol |
相同条件下,相同浓度的盐酸分别与镁、铝、铁3种金属恰好完全反应,产生相同体积的氢气(相同状况下),则下列说法正确的是
| A.开始时,产生氢气的速率相同 |
| B.所得溶液的pH相同 |
| C.所得溶液的质量相等 |
| D.参加反应的金属的质量比为12∶9∶28 |
一定条件下,中学化学常见物质甲、乙之间存在如下转化关系,乙是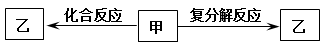
| A.HCl | B.FeCl2 | C.KOH | D.NaHCO3 |
向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是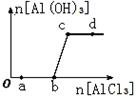
| A.a点对应的溶液中:Na+、Mg2+、SO42—、HCO3— |
| B.b点对应的溶液中:Na+、NH4+、SO42—、Cl- |
| C.c点对应的溶液中:Ag+、Ca2+、NO3—、Cl- |
| D.d点对应的溶液中:K+、NH4+、I-、SO42— |
关于FeCl3进行的实验,下列预测正确的是
| A.蒸发FeCl3溶液,得到FeCl3固体 |
| B.在FeCl3、CuCl2混合液中,加入少量Fe粉,一定有H2产生且有Cu析出 |
| C.用FeCl3固体溶于水配制饱和溶液,会有Fe(OH)3沉淀产生 |
| D.在FeCl3溶液中,加入KHCO3溶液,有CO2产生,但无Fe(OH)3沉淀生成 |