化学是一门以实验为基础的自然科学,下图所示实验是我们所熟悉的。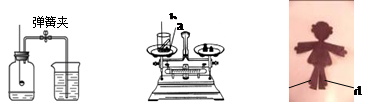
甲 乙 丙
(1)图甲所示实验用于测定空气中氧气的体积分数。红磷在空气中燃烧的化学方程式是 。关于该实验的下列说法中,正确的是 (填字母序号)。
| A.实验时红磷一定要足量 | B.红磷熄灭后立刻打开弹簧夹 |
| C.最终进入瓶中水的体积约为氧气的体积 | D.该实验必须检查装置的气密性 |
(2)同学们用乙所示实验探究化学反应前后物质的质量关系。如果第一次a、b分别是铁钉和硫酸铜溶液,第二次a、b分别是锌和稀盐酸(已知:Fe+CuSO4  FeSO4+Cu ;Zn+2HCl
FeSO4+Cu ;Zn+2HCl ZnCl2+H2↑),测定结果不同的原因是 。
ZnCl2+H2↑),测定结果不同的原因是 。
(3)如图丙所示,某化学课外小组将紫色石蕊试液浸泡并晾干的紫色纸人,进行以下实验:
①左右两袖分别用毛笔涂上稀醋酸和稀盐酸,可观察到两袖均变红色;
②将“c”裤腿涂上蒸馏水;
③将纸人放入盛有干燥二氧化碳气体的集气瓶中;解释步骤③中“c”裤腿呈红色的原因
(用化学方程式表示)。
下图是提纯CO、CO2混合气体中的CO并还原氧化铁的示意图。请回答有关问题: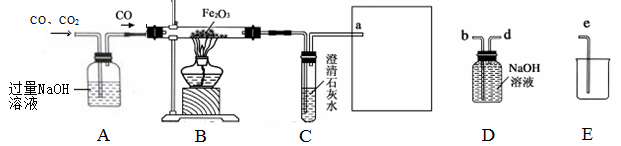
(1)为避免一氧化碳污染空气,并回收利用一氧化碳,方框中连接的是D和E,导管接口的连接顺序为a→ ()→()→ ()。D装置中NaOH的作用是。
如果导管连接错误,后果是____________ ____________________________。
(2)实验进行一段时间后,B装置的玻璃管中的现象为,反应方程式为。用这种方法“炼”得的铁与工业上炼出的生铁在组成上的最大区别是_____________ ____________。
(3)实验结束后,要从A装置的混合溶液中回收得到较纯净的NaOH固体。
资料显示,在不同温度下NaOH的溶解度如下:
| 温度(℃) |
10 |
20 |
40 |
60 |
80 |
100 |
| 溶解度(g/100g水) |
64 |
85 |
138 |
203 |
285 |
376 |
利用实验室的试剂和条件,实验步骤如下(其中Ⅰ、Ⅱ、Ⅲ为实验操作):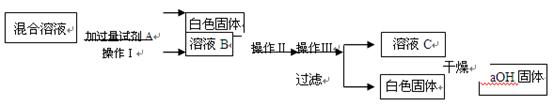

请具体填写试剂A的化学式以及实验操作Ⅰ、Ⅱ、Ⅲ的名称。
①化学式:A_________ ____________;
②操作名称:Ⅰ_________ ________ Ⅱ________ ___________ Ⅲ________ __________。
③如果在操作Ⅱ的过程中,溶液B中出现少量浑浊,原因可能是。
能源“非石油化”是战略目标,发展以CH4、CO2等原料的 “C1化学”成为当今化工生产的必然趋势。通常天然气中含有H2S等有毒气体,下图为天然气合成氨(NH3)的工艺流程: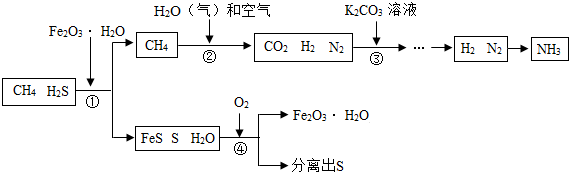
(1)合成氨的原料之一为氮气,该流程中为合成氨提供氮气的物质是。
(2)①处加入Fe2O3·H2O的目的是。
(3)②处CH4与H2O(气)反应生成CO2、H2,反应的化学方程式是(反应条件略去)。
(4)③处一般加入K2CO3溶液以吸收CO2 ,K2CO3溶液与CO2反应生成碳酸氢钾(KHCO3),该反应的化学方程式是 。
(5)该流程中参与循环的物质是。
同学们在实验室进行“粗盐中难溶性杂质的去除”实验。以下是小丽同学的实验报告部分内容。
【实验目的】粗盐中难溶性杂质的去除
【实验过程】
①用托盘天平称取5.0g粗盐,并全部加入到盛有10mL水的烧杯里,边加边用玻璃棒搅拌;
②过滤食盐水,观察滤液无色透明;
③将所得澄清滤液倒入蒸发皿,加热,并用玻璃棒不断搅拌,当液体蒸干时,停止加热;
④用玻璃棒把固体转移到纸上,称量,计算所得精盐的产率。
【实验分析】
(1)步骤①中因为,导致实验后精盐产率比其他同学偏低。
(2)步骤③中出现的错误操作是
该操作中玻璃棒的作用
A.加快蒸发速率 B.防止因局部温度过高,造成液滴飞溅 C.引流
【实验反思】经过这样操作所得到的精盐是纯净物吗?
【查阅教材】粗盐中含有多种可溶性杂质(氯化镁、氯化钙等)和不溶性杂质(泥沙等)。
【实验设计】
| 实验操作 |
预计实验现象 |
实验结论及解释 |
| ①将少量所得精盐溶于水,滴加少量稀NaOH溶液 |
所得精盐中可能含有氯化镁 化学方程式 |
|
| ②取实验①中的上层清液继续滴加NaOH溶液至不再有沉淀时,在上层清液中再滴加 溶液 |
出现白色沉淀 |
所得精盐中可能含有氯化钙 化学方程式 |
【实验结论】除去难溶性杂质得到的精盐不是纯净物。
下图是关于探究燃烧条件的三个实验装置。
(1)写出白磷燃烧的化学方程式;
(2)与甲图装置相比,乙图装置的优点是:;
有同学提出乙图装置仍然有不足之处,请你设计实验进行改进。 用文字描述或画出实验装置图。
。
(3)丙图装置中木屑燃烧,煤粉没有燃烧,说明燃烧的条件之一是。
母亲节前夕,阳阳对妈妈给外婆购买的“XX牌”苏打饼干及其配料表产生了浓厚的兴趣。在化学课上,阳阳听老师说过,苏打是碳酸钠(Na2CO3)的一个俗名,她再仔细阅读该饼干的配料表如下:小麦粉、小苏打……。她思考:配料中小苏打有何作用?如何鉴别苏打(Na2CO3)和小苏打(NaHCO3)?……
下面是阳阳进行的研究性学习过程,请你参与并回答相关问题。
【资料获悉】
1.相同条件下,Na2CO3溶液比NaHCO3溶液的碱性强;
2.20℃时,Na2CO3、NaHCO3的溶解度分别为21.3g和9.6g;
3.NaHCO3在2700C时能发生如下分解反应:2NaHCO3加热Na2CO3+H2O+CO2↑
而Na2CO3受热不易分解。
【实验过程】
实验一:验证Na2CO3和NaHCO3热稳定性的差异。在老师的指导下,你们按题18图所示进行实验若实验现象为,则能得出NaHCO3受热易分解,Na2CO3受热不易分解。
实验二:用酸碱度的差异鉴别Na2CO3和NaHCO3。你们若用广泛pH试纸测定相同条件下两种溶液的pH,则pH较大的是。
实验三:用20℃时溶解度的差异鉴别Na2CO3和NaHCO3
请完成下表:(忽略溶解过程中热量的变化)
| 实验操作 |
预期的现象和结论 |
| (3) |
(4) |
【交流总结】
1.配料中小苏打主要起发泡作用。
2.可以通过溶解度、酸碱度等差异来鉴别Na2CO3和NaHCO3。
【拓展延伸】
通过上述研究性学习过程。你们认为小苏打(NaHCO3)除用于食品工业外,在日常生活及实验室中还有哪些应用,试举一例:。