下列框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如下图所示(部分产物及反应条件已略去)。已知A、B为气态单质,F是地壳中含量最多的金属元素的单质;E、H、I为氧化物,E为黑色固体,I为红棕色气体;M为红褐色沉淀。
请回答下列问题:
(1)B中所含元素位于周期表中第 周期, 族。
(2)A在B中燃烧的现象是 。
(3) 的反应中,被氧化与被还原的物质的物质的量比是 。
的反应中,被氧化与被还原的物质的物质的量比是 。
(4)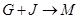 的离子方程式是 。
的离子方程式是 。
(5)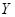 受热分解的化学方程式是 。
受热分解的化学方程式是 。
根据下列变化进行推断:
已知强热A产生的气态物质的平均相对分子质量为26.3。
(1)推断A、B、C、D的化学式:A____________、B____________、C____________、D____________。
(2)写出①②变化的离子方程式。
一种无色澄清溶液可能含有K+、SO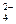 、NH
、NH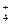 、Ba2+、H2PO
、Ba2+、H2PO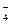 、NO
、NO 中的一种或几种,分别取少量溶液进行下列实验:①此溶液加入NaOH溶液有沉淀产生,加热产生一种使湿润红色石蕊试纸变蓝的气体。②另取原溶液浓缩后加入浓硫酸、铜片并加热,产生红棕色气体。由此可知此溶液中一定含有_______离子,一定不含有_______离子。
中的一种或几种,分别取少量溶液进行下列实验:①此溶液加入NaOH溶液有沉淀产生,加热产生一种使湿润红色石蕊试纸变蓝的气体。②另取原溶液浓缩后加入浓硫酸、铜片并加热,产生红棕色气体。由此可知此溶液中一定含有_______离子,一定不含有_______离子。
下图中①~ 分别代表有关反应中的一种物质,请填写以下空白。
分别代表有关反应中的一种物质,请填写以下空白。
(1)①③④的化学式分别是 、 、 。
(2)⑧与⑨反应的化学方程式是 。
从物质A(某正盐)的水溶液出发有下图所示的一系列变化。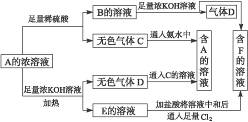
写出A、B、C、D、E、F的化学式。
元素R有两种氯化物RClm和RCln,其相对分子质量之差为71,Cl的质量分数在RClm中为85%,在RClm中为77%,则:
(1)m-n=______________,m=______________,R的相对分子质量=______________;
(2)通常R有两种同素异形体,其名称是__________________和________________。