信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
请回答下列问题:
⑴ 第①步Cu与混酸反应的离子方程式为______________________________;
得到滤渣1的主要成分为______________ _____。
⑵ 第②步加H2O2的作用是_____________________,使用H2O2的优点是_________;调溶液pH的目的是使_______________________________生成沉淀。
⑶ 简述第③步由滤液2得到CuSO4·5H2O的方法是________________________ 。
⑷ 由滤渣2制取Al2(SO4)3·18H2O ,探究小组设计了三种方案:
上述三种方案中,_________________方案不可行,原因是_________________________:
从原子利用率角度考虑,___________方案更合理。
⑸ 探究小组用滴定法测定CuSO4·5H2O (Mr=250)含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol·L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。滴定反应如下:Cu2+ + H2Y2-= CuY2- + 2H+
写出计算CuSO4·5H2O质量分数的表达式ω= _____________________________ ;
下列操作会导致CuSO4·5H2O含量的测定结果偏高的是_____________。
a.未干燥锥形瓶 b.滴定终点时滴定管尖嘴中产生气泡
c.未除净可与EDTA反应的干扰离子
(3分)在烧杯或试管里进行固体物质的溶解时,为了加快溶解速度,常采用的方法有___________、_____________、______________等。
海洋植物如海带、海藻中含有丰富的碘元素,碘元素以离子的形式存在。实验中从海藻提取碘的流程图如下:
(1)指出提取碘的过程中有关的实验操作名称①写出过程②中有关反应的离子方程式:
(2)提取碘的过程③中可选择的有机试剂为
| A.酒精、四氯化碳 | B.四氯化碳、苯 |
| C.汽油、醋酸 | D.汽油、甘油 |
(3)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:
(4)在过程④的操作中发现晶体碘大量附着在烧瓶内壁上,是由于碘具有性质
硫酸铜是一种应用极其广泛的化工原料.某课外兴趣小组将适量浓硝酸分多次加到铜粉与稀硫酸的混合物中,加热使之反应完全(装置如图I、图Ⅱ所示),通过蒸发、结晶得到硫酸铜晶体,并同时测定硫酸铜晶体中结晶水的含量.
(1)怎样检查图I装置的气密性。
(2)图I中分液漏斗内装的液体是。
(3)图Ⅱ是图Ⅰ的改进装置,与图I相比,图Ⅱ装置的明显优点是,
,,(可不答满).
(4)课外兴趣小组同学在测定胆矾(CuSO4·χH2O)晶体中结晶水的含量时.测得有关数据如下表:
| 加热前质量 |
加热后质量 |
|
| m1(容器) |
m2(容器+晶体) |
m3(容器+无水CuSO4) |
| 5.4g |
7.9g |
6.8g |
①为完成测定,图Ⅲ中还缺少的仪器名称是。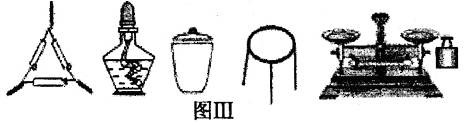
②判断样品已恒重的方法是。
③测定所得胆矾(CuSO4·χH2O)中结晶水含量的实验中,称量操作至少进行次。
④课外兴趣小组的测定结果x值(与CuSO4·5H2O相比)(填“偏高”、“偏低”、“不变”),可能的原因是。(填字母序号)
a.加热温度过高
b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却
d.胆矾晶体部分风化
无水氯化铝是白色晶体,易吸收水分,在178℃升华,装有无水氯化铝的试剂瓶久置于潮湿空气中,会自动爆炸并产生大量白雾。氯化铝常作为有机合成和石油工业的催化剂,并用于处理润滑油等。工业上由金属铝和氯气作用或由无水氯化氢气体与熔融金属铝作用制得。






某课外兴趣小组在实验室中,通过下图装置制取少量纯净的无水氯化铝。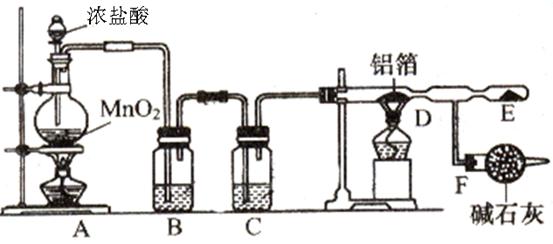
(1)A装置中发生反应的化学方程式为;
(2)B、C装置中应盛放的试剂名称分别为、;
(3)从A装置导出的气体若不经过B、C装置而直接进入D管,将对实验产生的不良后果是;
(4)F装置所起的作用是。
(6分)实验室进行下列实验:①制乙烯②制乙炔③石油分馏④苯的硝化⑤制溴苯⑥制乙酸乙酯
(1)不需要加热的有__________________;
(2)需要水浴的有____________________;
(3)需要用温度计的有_______;其中温度计插入反应液中的有______;
(4)需加催化剂的有__________________;
(5)加入浓H2SO4且起催化剂、脱水剂作用的有________________。